题目内容
19.室温下,对于0.10mol•L-1的氨水,下列判断正确的是( )| A. | 与AlCl3溶液反应发生的离子方程式为 Al3++3OH-═Al(OH)3↓ | |
| B. | 用HNO3溶液完全中和后,溶液不显中性 | |
| C. | 加水稀释后,溶液中c(NH${\;}_{4}^{+}$)•c(OH-)变大 | |
| D. | 1L0.1mol•L-1的氨水中有6.02×1022个NH${\;}_{4}^{+}$ |
分析 A.弱电解质要写化学式,且氢氧化铝不溶于弱碱;
B.硝酸铵是强酸弱碱盐,其溶液呈酸性;
C.加水稀释促进一水合氨电离,但铵根离子、氢氧根离子浓度都减小;
D.一水合氨是弱电解质,在氨水中部分电离.
解答 解:A.一水合氨是弱电解质,离子方程式中要写化学式,该反应的离子方程式为:Al3++3NH3.H2O═Al(OH)3↓+3NH4+,故A错误;
B.含有弱根离子的盐,谁强谁显性,硝酸铵是强酸弱碱盐,所以其溶液呈酸性,故B正确;
C.加水稀释促进一水合氨电离,但铵根离子、氢氧根离子浓度都减小,所以c(NH4+)•c(OH-)减小,故C错误;
D.一水合氨是弱电解质,在氨水中部分电离,所以1L0.1mol•L-1的氨水中NH4+的数目小于6.02×1022,故D错误;
故选B.
点评 本题考查弱电解质的电离、离子方程式的书写、盐类的水解等知识点,根据盐类水解特点、弱电解质的电离特点、离子方程式的书写规则来分析解答即可,难度不大.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
7.如图表示反应2A(g)+b(g)?2C(g)△H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是( )

| A. | t1时减小了A(g)的浓度,增加了C(g)的浓度,平衡向逆反应方向移动 | |
| B. | t1时升高了温度,平衡向逆反应方向移动 | |
| C. | t1时增加了A(g)和B(g)的浓度,平衡向正反应方向移动 | |
| D. | t1时减小了压强,平衡向逆反应方向移动 |
14.下列分子中所有原子均满足最外层8电子结构的是( )
| A. | LiCl | B. | NCl3 | C. | PCl5 | D. | BF3 |
4.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 100mL、1mol•L-1的AlCl3溶液中,含Al3+的数目为0.1NA | |
| B. | 46g乙醇中所含共价键的数目为8NA | |
| C. | 1mol氧气与足量金属钠反应,氧气一定得到4NA个电子 | |
| D. | 100mL、18.4mol/L的硫酸与足量铜反应,生成二氧化硫的分子数0.92NA |
11.元素周期表是元素周期律的具体表现形式.下列说法正确的是( )
| A. | 元素的原子结构决定了元素在周期表中的位置 | |
| B. | 同一周期从左到右,元素的金属性逐渐增强、非金属性逐渐减弱 | |
| C. | 第IA元素全部是金属元素 | |
| D. | 可在过渡元素中寻找半导体材料 |
8.下列说法错误的是( )
| A. | 以2-氯丙烷为主要原料制备1,2-丙二醇[CH3CH(OH)CH2OH]时,依次经过的反应类型为消去反应-加成反应-取代反应 | |
| B. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| C. | 有机物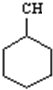 的一氯代物有4种 的一氯代物有4种 | |
| D. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O |
9.某同学探究溶液的酸碱性对FeCl3水解平衡的影响,实验方案如下:
配制50mL0.001mol/L FeCl3溶液、50mL对照组溶液x,向两种溶液中分别滴加1滴1mol/L HCl溶液、1滴1mol/L NaOH 溶液,测得溶液pH随时间变化的曲线如图所示.下列说法不正确的是( )
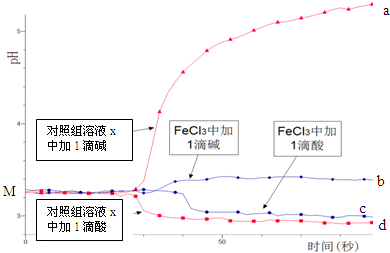
配制50mL0.001mol/L FeCl3溶液、50mL对照组溶液x,向两种溶液中分别滴加1滴1mol/L HCl溶液、1滴1mol/L NaOH 溶液,测得溶液pH随时间变化的曲线如图所示.下列说法不正确的是( )

| A. | 依据M点对应的pH,说明Fe3+发生了水解反应 | |
| B. | 对照组溶液x的组成可能是0.003 mol/L KCl | |
| C. | 依据曲线c和d说明Fe3+水解平衡发生了移动 | |
| D. | 通过仪器检测体系浑浊度的变化,可表征水解平衡移动的方向 |