题目内容
10.(1)氢气在燃烧时,放出大量热量,这是由于反应物的总能量大于生成物的总能量(填“大于”或“小于”);从化学反应的本质角度来看,是由于断裂反应物中的化学键吸收的总能量小于形成产物的化学键放出的总能量(填“大于”或“小于”).(2)氢气在氯气中燃烧时产生苍白色火焰.在反应过程中,破坏1mol H-H键消耗的能量为Q1 kJ,破坏1mol Cl2中的化学键消耗的能量为Q2 kJ,形成1mol HCl中的化学键释放的能量为Q3 kJ. 该反应是释放能量反应(“释放能量”“吸收能量”),该过程中释放或吸收的能量的数值为Q1+Q2-2Q3kJ.
分析 (1)氢气在燃烧时,放出大量热量,属于放热反应,依据能量守恒判断能量变化,断裂化学键吸收能量,形成化学键放出能量,二者大小决定反应是吸热或放热反应;
(2)根据反应热△H=反应物的总键能-生成物的总键来计算该反应的反应热,氢气在氯气中燃烧,反应热△H<0,据此解答.
解答 解:(1)氢气在燃烧时,放出大量热量,属于放热反应,反应物的总能量大于生成物的总能量,放热反应中断裂反应物中的化学键吸收的总能量小于形成产物的化学键放出的总能量,
故答案为:大于;小于;
(2)破坏1mol氢气的化学键消耗的能量为Q1kJ,破坏1mol氯气的化学键消耗的能量为Q2kJ,形成1mol氯化氢中的化学键释放的能量为Q3kJ,对于H2(g)+Cl2(g)═2HCl(g) 反应热△H=反应物的总键能-生成物的总键能=Q1kJ/mol+Q2kJ/mol-2Q3kJ/mol=(Q1+Q2-2Q3)kJ/mol.由于氢气在氯气中燃烧,反应热△H<0,即(Q1+Q2-2Q3)<0,所以是放热反应,反应过程中释放能量数值为Q1+Q2-2Q3KJ,
故答案为:释放能量;Q1+Q2-2Q3.
点评 本题考查了化学反应能量变化,化学反应实质和能量变化的判断,注意利用化学键断裂和形成、键能大小、物质能量大小就是分析反应能量的变化是解题关键,题目难度不大.

练习册系列答案
相关题目
18.${\;}_{53}^{131}I$是常规核裂变产物之一,可以通过测定大气或水中${\;}_{53}^{131}I$的含量变化来检测核电站是否发生放射性物质泄漏.下列有关${\;}_{53}^{131}I$的叙述中错误的是( )
| A. | ${\;}_{53}^{131}I$的化学性质与${\;}_{53}^{127}I$相同 | |
| B. | ${\;}_{53}^{131}I$的原子序数为53 | |
| C. | ${\;}_{53}^{131}I$的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}I$的原子核内中子与质子数之差为25 |
15. 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )
 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )| A. | N4属于一种新型的化合物 | |
| B. | N4分子中N-N键角为109°28′ | |
| C. | N4分子中存在非极性键 | |
| D. | 1 mol N4转变成N2将吸收882 kJ热量 |
2.下列有关溶液的说法不正确的是( )
| A. | 向1mol•L-1的氨水中加少里硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| B. | 物质的量浓度相等的①(NH4)2SO4溶液②NH4HCO3溶液③NH4Cl溶液④(NH4)2Fe(SO4)2溶液液中,c(NH${\;}_{4}^{+}$)的大小关系:④>①>③>② | |
| C. | 将2mol•L-1的某一元酸HA溶液和1mol•L-1 NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(OH-)+c(A-)=c(H+)+c(HA) | |
| D. | 物质的量浓度之比为 1:1 的NaClO、NaHCO3混合溶液中:c(HC10)+c(ClO-)=c(C0${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+c(H2CO3) |
19.室温下,对于0.10mol•L-1的氨水,下列判断正确的是( )
| A. | 与AlCl3溶液反应发生的离子方程式为 Al3++3OH-═Al(OH)3↓ | |
| B. | 用HNO3溶液完全中和后,溶液不显中性 | |
| C. | 加水稀释后,溶液中c(NH${\;}_{4}^{+}$)•c(OH-)变大 | |
| D. | 1L0.1mol•L-1的氨水中有6.02×1022个NH${\;}_{4}^{+}$ |
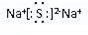 ;
;
 ,3,4-二甲基-4-乙基庚烷的结构简式为CH3CH2CH(CH3)C(CH3)(CH2CH3)CH2CH2CH3.
,3,4-二甲基-4-乙基庚烷的结构简式为CH3CH2CH(CH3)C(CH3)(CH2CH3)CH2CH2CH3.