题目内容
11.元素周期表是元素周期律的具体表现形式.下列说法正确的是( )| A. | 元素的原子结构决定了元素在周期表中的位置 | |
| B. | 同一周期从左到右,元素的金属性逐渐增强、非金属性逐渐减弱 | |
| C. | 第IA元素全部是金属元素 | |
| D. | 可在过渡元素中寻找半导体材料 |
分析 A.原子核外电子层数以及最外层电子数与周期表的周期、族有关;
B.同一周期从左到右,元素的金属性逐渐减弱、非金属性逐渐增强;
C.第IA元素H为非金属;
D.半导体材料在金属和非金属的分界线寻找.
解答 解:A.电子层相同的元素排在同一横行,自左而右按核电荷数递增顺序排列,不同横行中最外层电子数相同的元素,按电子层增多的顺序由上而下排成纵行,故元素的原子结构决定了元素在周期表中的位置,故A正确;
B.同一周期从左到右,元素的金属性逐渐减弱、非金属性逐渐增强,故B错误;
C.第IA元素H为非金属,其它为金属,故C错误;
D.半导体材料在金属和非金属的分界线寻找,故D错误.
故选A.
点评 本题考查元素周期律,为高频考点,题目难度不大,熟悉元素在周期表中的位置及元素的性质即可解答,注重元素位置与性质的考查.

练习册系列答案
相关题目
2.下列有关溶液的说法不正确的是( )
| A. | 向1mol•L-1的氨水中加少里硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| B. | 物质的量浓度相等的①(NH4)2SO4溶液②NH4HCO3溶液③NH4Cl溶液④(NH4)2Fe(SO4)2溶液液中,c(NH${\;}_{4}^{+}$)的大小关系:④>①>③>② | |
| C. | 将2mol•L-1的某一元酸HA溶液和1mol•L-1 NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(OH-)+c(A-)=c(H+)+c(HA) | |
| D. | 物质的量浓度之比为 1:1 的NaClO、NaHCO3混合溶液中:c(HC10)+c(ClO-)=c(C0${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+c(H2CO3) |
19.室温下,对于0.10mol•L-1的氨水,下列判断正确的是( )
| A. | 与AlCl3溶液反应发生的离子方程式为 Al3++3OH-═Al(OH)3↓ | |
| B. | 用HNO3溶液完全中和后,溶液不显中性 | |
| C. | 加水稀释后,溶液中c(NH${\;}_{4}^{+}$)•c(OH-)变大 | |
| D. | 1L0.1mol•L-1的氨水中有6.02×1022个NH${\;}_{4}^{+}$ |
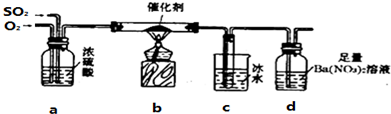
6. 有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Fe3+、Mg2+、Cu2+、Al3+、NO3-、CO32-)、SO42-,现取二份100mL溶液进行如下实验:
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Fe3+、Mg2+、Cu2+、Al3+、NO3-、CO32-)、SO42-,现取二份100mL溶液进行如下实验:
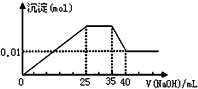
①第一份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为9.32g.
根据上述实验,以下推测不正确的是( )
 有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Fe3+、Mg2+、Cu2+、Al3+、NO3-、CO32-)、SO42-,现取二份100mL溶液进行如下实验:
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Fe3+、Mg2+、Cu2+、Al3+、NO3-、CO32-)、SO42-,现取二份100mL溶液进行如下实验:①第一份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为9.32g.
根据上述实验,以下推测不正确的是( )
| A. | 原溶液一定不存在H+、Cu2+、CO32-、Fe3+ | |
| B. | 不能确定原溶液是否含有K+、NO3- | |
| C. | 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n(NH4+)=1:1:2 | |
| D. | 实验所加的NaOH的浓度为2mol•L-1 |
16.下列说法正确的是( )
| A. | C2H4与C4H8一定是同系物 | |
| B. | 丙烯和乙烷都能使高锰酸钾酸性溶液褪色 | |
| C. | 1丁烯与2丁烯互为同分异构体 | |
| D. | 新戊烷和2,2二甲基丙烷互为同分异构体 |
 ,3,4-二甲基-4-乙基庚烷的结构简式为CH3CH2CH(CH3)C(CH3)(CH2CH3)CH2CH2CH3.
,3,4-二甲基-4-乙基庚烷的结构简式为CH3CH2CH(CH3)C(CH3)(CH2CH3)CH2CH2CH3.