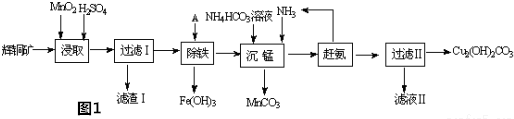
题目内容
4.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 100mL、1mol•L-1的AlCl3溶液中,含Al3+的数目为0.1NA | |
| B. | 46g乙醇中所含共价键的数目为8NA | |
| C. | 1mol氧气与足量金属钠反应,氧气一定得到4NA个电子 | |
| D. | 100mL、18.4mol/L的硫酸与足量铜反应,生成二氧化硫的分子数0.92NA |
分析 A.铝离子为弱碱阳离子,水溶液中部分水解;
B.求出乙醇的物质的量,然后根据乙醇中含8条共价键来分析;
C.生成产物是过氧化钠,氧的化合价是-1价;
D.浓硫酸随着反应的进行,变成稀硫酸就不再反应;
解答 解:A.100mL、1mol•L-1的AlCl3溶液中,铝离子部分水解,含Al3+的数目小于0.1NA,故A错误;
B.46g乙醇的物质的量为n=$\frac{46g}{46g/mol}$=1mol,而乙醇中含8条共价键,故1mol乙醇中含8mol共价键即8NA个,故B正确;
C.Na2O2中氧元素的化合价是-1价,1mol氧气反应,得到2mol电子,即2NA个电子,故C错误;
D.由于铜足量,浓硫酸变成稀硫酸后,不再参加反应,故生成二氧化硫的分子数一定小于0.92NA,故D错误;
故选:B.
点评 本题借助阿伏伽德罗常数,考查了氧化还原反应中的电子转移数量的计算,有机物含共价键的计算,铜与浓硫酸的反应,熟练掌握公式的使用和物质的结构、性质是解题关键,题目难度不大.

练习册系列答案
相关题目
14.下列有机反应的化学方程式正确的是( )
| A. | CH3CH2Br+NaOH$→_{△}^{H_{2}O}$CH2=CH2↑+NaBr+H2O | |
| B. | 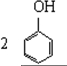 +3Br2→ +3Br2→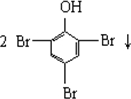 | |
| C. | nCH2=CH-CH3$\stackrel{一定条件}{→}$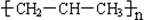 | |
| D. | CH3CHO+NaOH+2Cu(OH)2$\stackrel{加热}{→}$ CH3COONa+Cu2O↓+3H2O. |
15. 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )
 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )| A. | N4属于一种新型的化合物 | |
| B. | N4分子中N-N键角为109°28′ | |
| C. | N4分子中存在非极性键 | |
| D. | 1 mol N4转变成N2将吸收882 kJ热量 |
19.室温下,对于0.10mol•L-1的氨水,下列判断正确的是( )
| A. | 与AlCl3溶液反应发生的离子方程式为 Al3++3OH-═Al(OH)3↓ | |
| B. | 用HNO3溶液完全中和后,溶液不显中性 | |
| C. | 加水稀释后,溶液中c(NH${\;}_{4}^{+}$)•c(OH-)变大 | |
| D. | 1L0.1mol•L-1的氨水中有6.02×1022个NH${\;}_{4}^{+}$ |
9.下列各组物质中,化学键类型不同的是( )
| A. | NaCl和K2O | B. | H2O和NH3 | C. | CaF2和NaCl | D. | CCl4和Na2 SO3 |
16.下列说法正确的是( )
| A. | C2H4与C4H8一定是同系物 | |
| B. | 丙烯和乙烷都能使高锰酸钾酸性溶液褪色 | |
| C. | 1丁烯与2丁烯互为同分异构体 | |
| D. | 新戊烷和2,2二甲基丙烷互为同分异构体 |
13.最近日本科学家确认世界上还存在的另一种“分子足球”N60,它与C60的结构相似.下列说法正确的是( )
| A. | N60和N2是同素异形体 | B. | N60中氮原子之间由共价键结合 | ||
| C. | N60高温或撞击后应该生成N2 | D. | N60和14N都是氮的同位素 |
14.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 常温下,22gCO2含碳氧双键数目为2NA | |
| B. | 标准状况下,22.4LBr2中所含分子数为NA | |
| C. | 12.0NaHSO4晶体中含阳离子数目为0.1NA | |
| D. | 7.8gNa2O2与足量 的水反应转移电子数目为0.2NA |