题目内容
6.Mg、Zn、Al三种金属的混合物与足量稀硫酸反应,生成氢气2.8L(标准状况),原三种金属的总物质的量(单位mol)可能是( )| A. | 0.125 | B. | 0.10 | C. | 0.08 | D. | 0.20 |
分析 Mg、Zn与硫酸反应都表现为+2价,Al与硫酸反应表现+3价,可把Mg、Zn看成一种成分,Al看成另一种成分,则把该混合物转化成+2价的金属和+3价的金属组成的混合物,然后用极端法计算,假设全部是Mg(Zn),假设全是Al,计算Mg、Al物质的量,实际混合物的物质的量之和应介于二者之间.
解答 解:氢气的物质的量=$\frac{2.8L}{22.4L/mol}$=0.125mol,
假设全部是Mg或Zn,设它们的物质的量之和为xmol,产生的H2有如下关系:
Mg(Zn)~H2
1mol 1mol
x 0.125mol
所以,1mol:1mol=xmol:0.125mol,解得x=0.125
假设全是Al,设它的物质的量为ymol,产生的H2关系为:
2 Al~3H2
2mol 3mol
y 0.125mol
所以,2mol:3mol=ymol:0.125mol,解得y=0.083
由于是以上两种情况的混合物,故混合物计算的物质的量之和应介于0.083mol~0.125mol之间,选项中只有B符合,
故选B.
点评 本题考查混合物的计算,难度中等,注意根据化合价将三组分看做二组分,再采取极端法解答,极端法是化学计算中的一种技巧性解法,对于混合物范围计算比较适用,该方法的解题思路是假设只有混合物中的某一成份,通过计算得出两个极端值.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列装置图中的实验方案能达到实验目的是( )


| A. | 图①可验证FeCl3对H2O2分解反应有催化作用 | |
| B. | 图②可用于中和热的测定 | |
| C. | 图③可用于探究铁作负极的原电池原理 | |
| D. | 图④可用于收集NH3 |
11.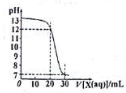 如图为用一定浓度的盐酸X滴定10mL一定浓度NaOH溶液Y的滴定图象,依据图象推出X和Y的物质的量浓度是下表内各组中的( )
如图为用一定浓度的盐酸X滴定10mL一定浓度NaOH溶液Y的滴定图象,依据图象推出X和Y的物质的量浓度是下表内各组中的( )
 如图为用一定浓度的盐酸X滴定10mL一定浓度NaOH溶液Y的滴定图象,依据图象推出X和Y的物质的量浓度是下表内各组中的( )
如图为用一定浓度的盐酸X滴定10mL一定浓度NaOH溶液Y的滴定图象,依据图象推出X和Y的物质的量浓度是下表内各组中的( )| A | B | C | D | |
| X/mol/L | 0.09 | 0.03 | 0.04 | 0.12 |
| Y/mol/L | 0.03 | 0.09 | 0.12 | 0.04 |
| A. | A | B. | B | C. | C | D. | D |

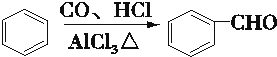
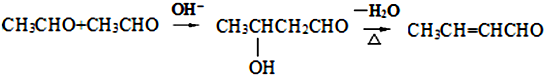
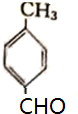 .
.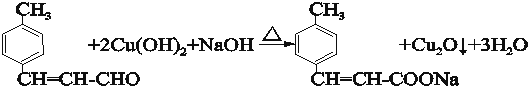 .
.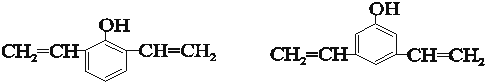 .
. 某课外活动小组用如图装置进行实验,试回答下列问题.
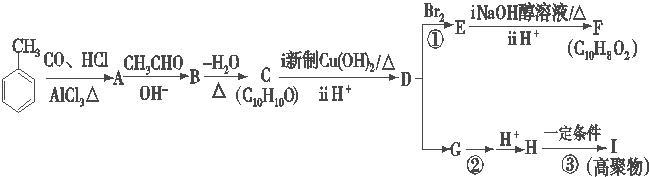
某课外活动小组用如图装置进行实验,试回答下列问题.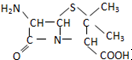 ) 是青霉素类抗生素的母核,与有机物F缩合生成阿莫西林.某同学用对甲基苯酚为原料设计阿莫西林的合成路线如图:
) 是青霉素类抗生素的母核,与有机物F缩合生成阿莫西林.某同学用对甲基苯酚为原料设计阿莫西林的合成路线如图: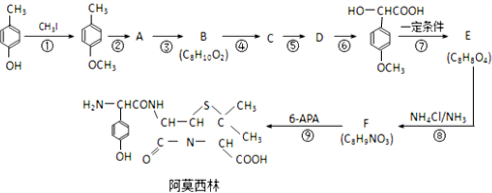
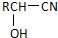 $\stackrel{H_{2}O/H+}{→}$
$\stackrel{H_{2}O/H+}{→}$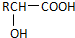
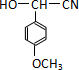 ;
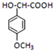
;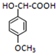 的一种同分异构体的一氯代物的结构为
的一种同分异构体的一氯代物的结构为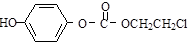 ,该物质在NaOH水溶液中加热反应反应时的化学方程式为
,该物质在NaOH水溶液中加热反应反应时的化学方程式为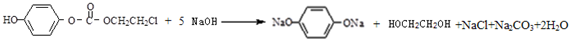 ;
; 满足以下条件的同分异构体有3种.
满足以下条件的同分异构体有3种.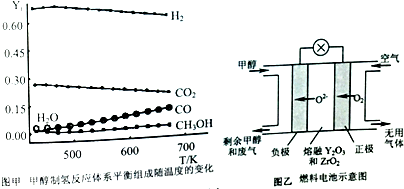
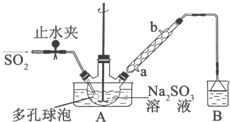 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下: