题目内容
15.随着化石能源的减少,新能源的开发利用日益迫切.(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
SO2(g)+I2(g)+2H2O(g)═2HI(g)+H2SO4(l)△H=a kJ•mol-1
2H2SO4(l)═2H2O(g)+2SO2(g)+O2(g)△H=b kJ•mol-1
2HI(g)═H2(g)+I2(g)△H=c kJ•mol-1
则:2H2O(g)═2H2(g)+O2(g)△H=(2a+b+2c)kJ•mol-1
(2)甲醇制氢有以下三个反应:
CH3OH(g)?CO(g)+2H2(g)△H=+90.8kJ•mol-1Ⅰ
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-43.5kJ•mol-1Ⅱ
CH3OH(g)+$\frac{1}{2}$O2(g)?CO2(g)+2H2(g)△H=-192.0kJ•mol-1Ⅲ
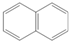
①当CH3OH(g)、O2(g)、H2O(g)总进料量为1mol时,且n(CH3OH):n(H2O):n(O2)=0.57:0.28:0.15,在0.1Mpa、473~673K温度范围内,各组分的平衡组成随温度变化的关系曲线如图甲.(图甲中Y1表示各气体的体积分数,氧气的平衡浓度接近0,图中未标出).下列说法正确的是AC.
A.在0.1Mpa、473~673K温度范围内,甲醇有很高的转化率
B.温度升高有利于氢气的制备
C.寻找在较低温度下的催化剂在本制氢工艺中至关重要
②已知反应Ⅱ在T1℃时K=1,向恒容的密闭容器中同时充入1.0mol CO、3.0mol H2O,达到平衡时CO的转化率为75%.在反应达到平衡后再向其中加入1.0mol CO、1.0mol H2O、1.0mol CO2和1.0mol H2,此时该反应的v正>v逆(填“>”、“<”或“﹦”).
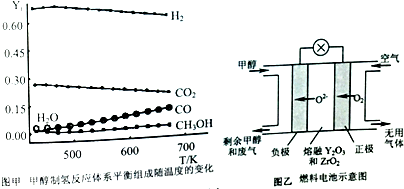
(3)一种以甲醇作燃料的电池示意图如图乙.写出该电池放电时负极的电极反应式:CH3OH-6e-+3O2-=CO2↑+2H2O.
分析 (1)依据热化学方程式和盖斯定律计算得到;
(2)①A、依据图象分析甲醇体积分数很小,说明转化率高;
B、生成氢气的反应Ⅱ、Ⅲ都是放热反应,升温反应逆向进行,氢气量减小;
C、低温有利于氢气生成,但反应速率小,寻找催化剂可以提高反应速率;
②反应ⅡCO(g)+H2O(g)=CO2(g)+H2(g)△H=-43.5kJ•mol-1 ,依据平衡三段式列式计算转化率,依据浓度商和平衡常数比较判断反应进行的方向;
(3)燃料电池中燃料在负极失电子发生氧化反应,电解质是熔融金属氧化物,甲醇失电子生成二氧化碳.
解答 解:(1)①SO2(g)+I2(g)+2H2O(g)=2HI (g)+H2SO4(l)△H=a kJ•mol-1
②2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g)△H=b kJ•mol-1
③2HI(g)=H2(g)+I2(g)△H=c kJ•mol-1
依据盖斯定律①×2+②+③×2得到2H2O(g)=2H2(g)+O2(g)△H=(2a+b+2c)KJ/mol,故答案为:(2a+b+2c);
(2)①A、依据图象分析,在0.1MPa、473~673K温度范围内甲醇体积分数很小,说明转化率高,故A正确;
B、生成氢气的反应Ⅱ、Ⅲ都是放热反应,升温反应逆向进行,氢气量减小,故B错误;
C、低温有利于氢气生成,但反应速率小,寻找催化剂可以提高反应速率,寻找在较低温度下的催化剂在本制氢工艺中至关重要,故C正确:
故答案为:AC;
②依据化学平衡三段式计算列式得到,设CO反应量为x,气体体积为v
CO(g)+H2O(g)=CO2(g)+H2(g)
起始量(mol) 1 3 0 0
变化量(mol) x x x x
平衡量(mol) 1-x 3-x x x
K=$\frac{\frac{n(C{O}_{2})}{V}×\frac{n({H}_{2})}{V}}{\frac{n(CO)}{V}×\frac{n({H}_{2}O)}{V}}$=$\frac{{x}^{2}}{(1-x)(3-x)}$=1
x=0.75
CO转化率=75%;
平衡常数随温度变化,不随浓度改变,反应达到平衡后再向其中加入1.0mol CO、1.0mol H2O、1.0mol CO2和1.0mol H2,则
CO(g)+H2O(g)=CO2(g)+H2(g)
1-0.75+1 3-0.75+1 0.75+1 0.75+1
Qc=$\frac{1.7{5}^{2}}{1.25×3.25}$=0.75<K,反应正向进行,正反应速率>逆反应速率,
故答案为:75%;>;
(3)甲醇作燃料的电池示意图中电解质是金属氧化物,甲醇失电子结合氧离子生成二氧化碳,结合电子守恒原子守恒写出负极电极反应为:CH3OH-6e-+3O2-=CO2↑+2H2O,
故答案为:CH3OH-6e-+3O2-=CO2↑+2H2O.
点评 本题考查了热化学方程式和盖斯定律的计算应用,化学平衡影响因素的分析判断,三段式计算的应用,平衡常数计算与计算分析,原电池电极反应书写方法,题目难度中等.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.0kJ•mol-1
该反应在工业上被称为“一氧化碳变换”.
(1)写出该反应的平衡常数表达式:K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$.
K(200℃)>K(300℃)(填“>”、“=”或“<”).
(2)恒温恒容条件下,以下能说明该反应达到平衡状态的是a(填字母序号).
a.ν消耗(CO)=ν生成(H2O) b.c(CO2)=c(CO)
c.混合气体的总物质的量不再改变 d.混合气体的密度不再改变
(3)某温度下,在一个容积为10L的密闭容器中加入1mol CO和4mol H2O(g),反应经20min后达到平衡,测得平衡时CO2的物质的量为0.8mol,该时间范围内反应的平均速率ν (CO )=0.004mol•L-1•min-1;平衡常数K的数值为1.
(4)某工业合成氨的原料气组成为:H2 40%、N2 20%、CO 30%、CO210%(均为体积分数).现采用“一氧化碳变换”法,向上述原料气中加入水蒸气,将其中的CO除去.已知不同温度及反应物投料比($\frac{n({H}_{2}O)}{n(CO)}$)下,变换后平衡混合气体中CO的体积分数如下表所示:
| 投料比 CO的体积分数% 温度/℃ | $\frac{n({H}_{2}O)}{n(CO)}$=1 | $\frac{n({H}_{2}O)}{n(CO)}$=3 | $\frac{n({H}_{2}O)}{n(CO)}$=5 |
| 200 250 300 350 | 1.70 2.73 6.00 7.85 | 0.21 0.30 0.84 1.52 | 0.02 0.06 0.43 0.80 |
②温度是一氧化碳变换工艺中最重要的工艺条件,实际生产过程中将温度控制在300℃左右,其原因是提高温度,会提高反应速率,但平衡逆向移动,CO的转化率下降,实际生产过程中应该综合考虑速率和平衡两个方面.
| A. | 0.125 | B. | 0.10 | C. | 0.08 | D. | 0.20 |
| A. | 氢氧化钠溶液盛装在玻璃塞的试剂瓶中 | |
| B. | 新制氯水保存在无色广口瓶中 | |
| C. | 铝片密封保存在细口瓶中 | |
| D. | 金属钠保存在煤油中 |
| A. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| B. | 加入氢氧化钠溶液,先产生白色沉淀,后迅速变为灰绿色,最后变为红褐色,一定有Fe2+ | |
| C. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| D. | 加入硝酸银溶液产生白色沉淀,再加稀硝酸,白色沉淀不溶解,一定有Ag+ |