题目内容
1.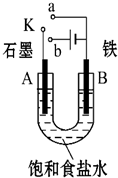 某课外活动小组用如图装置进行实验,试回答下列问题.
某课外活动小组用如图装置进行实验,试回答下列问题.(1)若开始时开关K与a连接,则B极的电极反应式为Fe-2e-=Fe2+.
(2)若开始时开关K与b连接,则B极的电极反应式为2H++2e-=H2↑,总反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-.
(3)若开关K与b连接,下列说法正确的是(填序号)②④.
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24L气体,则溶液中转移0.2mol电子
(4)如果模拟工业上离子交换膜法制烧碱的方法,将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为O2+4e-+2H2O═4OH-,.
分析 (1)若开始时开关K与a连接,则形成原电池反应,为铁的吸氧腐蚀;
(2)若开始时开关K与b连接,形成电解池装置,石墨为阳极,发生氧化反应生成氯气,铁为阴极,发生还原反应生成氢气和氢氧化钠,总的反应的离子方程式就是电解饱和食盐水;
(3)若开始时开关K与b连接,则形成电解池,A为阳极,发生氧化反应,生成氯气,B为阴极,生成氢气和氢氧化钠;
(4)正极发生还原反应,氧气放电生成氢氧根离子.
解答 解:(1)开始时开关K与a连接,是原电池,铁为负极,发生氧化反应,失去电子生成亚铁离子,电极方程式为Fe-2e-=Fe2+,A极上氧气得电子被还原,电极方程式为O2+2H2O+4e-=4OH-,
故答案为:Fe-2e-=Fe2+;
(2)开关K与b连接,装置为电解池,铁为阴极,发生还原反应,氢离子得到电子生成氢气,电极方程式为2H++2e-=H2↑,总的电极反应是电解饱和食盐水,电极反应方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,故答案为:2H++2e-=H2↑;2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;
(3)①电解时阳离子向阴极移动,故①错误;
②A生成氯气,能使湿润KI淀粉试纸变蓝,故②正确;
③阳极生成氯气,阴极生成氢气,则通入适量氯化氢可恢复到原浓度,故③错误;
④若标准状况下B极产生2.24L氢气,由2H++2e-=H2↑可知转移0.2mol电子,故④正确.
故答案为:②④;
(4)正极发生还原反应,氧气放电生成氢氧根离子,电极反应式为:O2+4e-+2H2O═4OH-,故答案为:O2+4e-+2H2O═4OH-.
点评 本题综合原电池和电解质知识,侧重于学生的分析能力和电化学知识的综合应用,注意解题时要注意分析电极反应及生成物,难度中等.

 全能测控一本好卷系列答案
全能测控一本好卷系列答案| A. | 将洁厕灵与84消毒液混合使用,能更有效的起到洁具除垢和卫生消毒作用 | |
| B. | 二氧化硫、氮氧化物和可入肺颗粒物是雾霾的主要成分,PM2.5就是指大气中直径小于或等于2.5微米的可入肺颗粒物 | |
| C. | 屠呦呦最早提出用乙醚提取青蒿,其提取物抗疟作用达95%到100%,这种提取原理就是蒸馏,属于物理过程 | |
| D. | 不锈钢具有较强的抗腐蚀性,是因为在钢铁表面镀上了金属铬 |
| A. | 0.125 | B. | 0.10 | C. | 0.08 | D. | 0.20 |
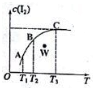 将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq),该平衡体系中,I2的物质的量浓度与温度(T)的关系如图所示(曲线上的任何一点都代表平衡状态),下列说法正确的是( )
将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq),该平衡体系中,I2的物质的量浓度与温度(T)的关系如图所示(曲线上的任何一点都代表平衡状态),下列说法正确的是( )| A. | 正反应为吸热反应 | B. | 平衡常数:KA>KB | ||
| C. | 反应速率:vB>vC | D. | W点时,v正>v逆 |

| A. | 3种单体通过缩聚反应聚合 | B. | 形成该化合物的单体只有2种 | ||
| C. | 其中一种单体为 | D. | 其中一种单体为1,5-二甲基苯酚 |