题目内容
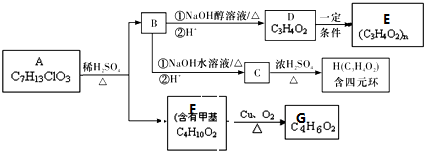
14.下列有机化合物转化关系如图所示: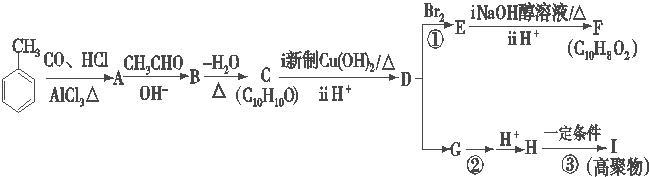
已知:(1)
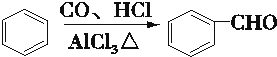
(2)
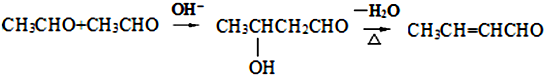
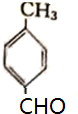
其中化合物A苯环上的一氯代物只有两种.请回答下列问题:
(1)写出A的结构简式
 .
.(2)B中含有的官能团的名称羟基、醛基.
(3)化合物F的核磁共振氢谱显示有4个峰.
(4)写出C与新制Cu(OH)2反应的化学方程式
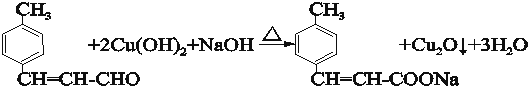 .
.(5)化合物C有多种同分异构体,请写出其中满足下列条件的所有同分异构体的结构简式
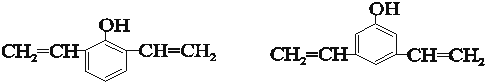 .
.①遇氯化铁溶液显紫色; ②苯环上有三个取代基; ③苯环上的一氯取代物只有两种.
分析 据已知信息和化合物A苯环上的一氯代物只有两种可知A为 ,A与CH3CHO发生信息所示的羟醛缩合反应生成B,B为
,A与CH3CHO发生信息所示的羟醛缩合反应生成B,B为 ,B发生消去反应生成C,C为
,B发生消去反应生成C,C为 ,C与新制氢氧化铜反应,醛基被氧化为羧基,D为
,C与新制氢氧化铜反应,醛基被氧化为羧基,D为 ,D与溴水发生加成反应后,在NaOH的乙醇溶液中发生消去反应酸化后生成F,F为
,D与溴水发生加成反应后,在NaOH的乙醇溶液中发生消去反应酸化后生成F,F为 ,两分子H能形成六元环酯,说明H为
,两分子H能形成六元环酯,说明H为 ,D→G是
,D→G是 与HX的加成反应,再在NaOH的水溶液中水解生成H,据此分析.
与HX的加成反应,再在NaOH的水溶液中水解生成H,据此分析.
解答 解:据已知信息和化合物A苯环上的一氯代物只有两种可知A为 ,A与CH3CHO发生信息所示的羟醛缩合反应生成B,B为
,A与CH3CHO发生信息所示的羟醛缩合反应生成B,B为 ,B发生消去反应生成C,C为
,B发生消去反应生成C,C为 ,C与新制氢氧化铜反应,醛基被氧化为羧基,D为
,C与新制氢氧化铜反应,醛基被氧化为羧基,D为 ,D与溴水发生加成反应后,在NaOH的乙醇溶液中发生消去反应酸化后生成F,F为
,D与溴水发生加成反应后,在NaOH的乙醇溶液中发生消去反应酸化后生成F,F为 ,两分子H能形成六元环酯,说明H为
,两分子H能形成六元环酯,说明H为 ,D→G是
,D→G是 与HX的加成反应,再在NaOH的水溶液中水解生成H,
与HX的加成反应,再在NaOH的水溶液中水解生成H,
(1)A的结构简式为 ,故答案为:
,故答案为: ;
;
(2)B为 ,B中官能团为羟基、醛基,故答案为:羟基、醛基;
,B中官能团为羟基、醛基,故答案为:羟基、醛基;
(3)F为 ,F中含有4种氢原子,所以其核磁共振氢谱吸收峰有4个,故答案为:4;
,F中含有4种氢原子,所以其核磁共振氢谱吸收峰有4个,故答案为:4;
(4)C为 ,含有醛基,能和新制氢氧化铜悬浊液发生氧化反应,反应方程式为
,含有醛基,能和新制氢氧化铜悬浊液发生氧化反应,反应方程式为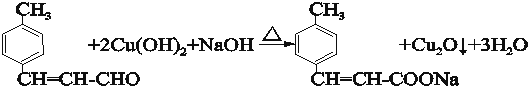 ,故答案为:
,故答案为: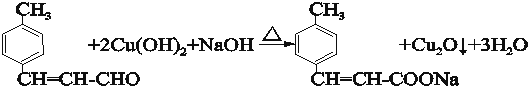 ;
;
(5)C为 ,其同分异构体①遇氯化铁溶液显紫色,说明有酚羟基,②苯环上有三个取代基 ③苯环上的一氯取代物只有两种,说明有两个取代基相同,为
,其同分异构体①遇氯化铁溶液显紫色,说明有酚羟基,②苯环上有三个取代基 ③苯环上的一氯取代物只有两种,说明有两个取代基相同,为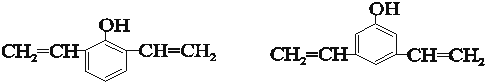 ,故答案为:
,故答案为: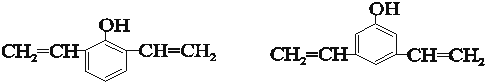 .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析判断及信息迁移能力,正确获取信息利用信息结合反应条件、某些物质结构简式进行推断,正确推断各物质结构简式是解本题关键,难点是限制性条件的同分异构体结构简式确定,题目难度中等.

练习册系列答案
相关题目
13.下列表述方式错误的是( )
| A. | Fe的基态原子外围电子排布图: | |
| B. | 氯化钠的分子式:NaCl | |
| C. | N的基态原子核外电子排布式:lS22S22p3 | |
| D. | HC10的结构式:H-O-Cl |
5.工业上由焦炭或天然气制氢气的过程中会产生一氧化碳.为了除去氢气中混有的一氧化碳,可在催化剂存在的条件下将一氧化碳与水蒸气发生反应:
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.0kJ•mol-1
该反应在工业上被称为“一氧化碳变换”.
(1)写出该反应的平衡常数表达式:K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$.
K(200℃)>K(300℃)(填“>”、“=”或“<”).
(2)恒温恒容条件下,以下能说明该反应达到平衡状态的是a(填字母序号).
a.ν消耗(CO)=ν生成(H2O) b.c(CO2)=c(CO)
c.混合气体的总物质的量不再改变 d.混合气体的密度不再改变
(3)某温度下,在一个容积为10L的密闭容器中加入1mol CO和4mol H2O(g),反应经20min后达到平衡,测得平衡时CO2的物质的量为0.8mol,该时间范围内反应的平均速率ν (CO )=0.004mol•L-1•min-1;平衡常数K的数值为1.
(4)某工业合成氨的原料气组成为:H2 40%、N2 20%、CO 30%、CO210%(均为体积分数).现采用“一氧化碳变换”法,向上述原料气中加入水蒸气,将其中的CO除去.已知不同温度及反应物投料比($\frac{n({H}_{2}O)}{n(CO)}$)下,变换后平衡混合气体中CO的体积分数如下表所示:
①从表中数据可以得到控制不同条件时CO的转化率的变化规律.能使CO的转化率升高,可改变的条件是降低温度、增大反应物投料比(或原料气中水蒸气的比例).
②温度是一氧化碳变换工艺中最重要的工艺条件,实际生产过程中将温度控制在300℃左右,其原因是提高温度,会提高反应速率,但平衡逆向移动,CO的转化率下降,实际生产过程中应该综合考虑速率和平衡两个方面.
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.0kJ•mol-1
该反应在工业上被称为“一氧化碳变换”.
(1)写出该反应的平衡常数表达式:K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$.
K(200℃)>K(300℃)(填“>”、“=”或“<”).
(2)恒温恒容条件下,以下能说明该反应达到平衡状态的是a(填字母序号).
a.ν消耗(CO)=ν生成(H2O) b.c(CO2)=c(CO)
c.混合气体的总物质的量不再改变 d.混合气体的密度不再改变
(3)某温度下,在一个容积为10L的密闭容器中加入1mol CO和4mol H2O(g),反应经20min后达到平衡,测得平衡时CO2的物质的量为0.8mol,该时间范围内反应的平均速率ν (CO )=0.004mol•L-1•min-1;平衡常数K的数值为1.
(4)某工业合成氨的原料气组成为:H2 40%、N2 20%、CO 30%、CO210%(均为体积分数).现采用“一氧化碳变换”法,向上述原料气中加入水蒸气,将其中的CO除去.已知不同温度及反应物投料比($\frac{n({H}_{2}O)}{n(CO)}$)下,变换后平衡混合气体中CO的体积分数如下表所示:
| 投料比 CO的体积分数% 温度/℃ | $\frac{n({H}_{2}O)}{n(CO)}$=1 | $\frac{n({H}_{2}O)}{n(CO)}$=3 | $\frac{n({H}_{2}O)}{n(CO)}$=5 |
| 200 250 300 350 | 1.70 2.73 6.00 7.85 | 0.21 0.30 0.84 1.52 | 0.02 0.06 0.43 0.80 |
②温度是一氧化碳变换工艺中最重要的工艺条件,实际生产过程中将温度控制在300℃左右,其原因是提高温度,会提高反应速率,但平衡逆向移动,CO的转化率下降,实际生产过程中应该综合考虑速率和平衡两个方面.
9.化学与生产、生活和社会密切相关.下列说法正确的是( )
| A. | 将洁厕灵与84消毒液混合使用,能更有效的起到洁具除垢和卫生消毒作用 | |
| B. | 二氧化硫、氮氧化物和可入肺颗粒物是雾霾的主要成分,PM2.5就是指大气中直径小于或等于2.5微米的可入肺颗粒物 | |
| C. | 屠呦呦最早提出用乙醚提取青蒿,其提取物抗疟作用达95%到100%,这种提取原理就是蒸馏,属于物理过程 | |
| D. | 不锈钢具有较强的抗腐蚀性,是因为在钢铁表面镀上了金属铬 |
6.Mg、Zn、Al三种金属的混合物与足量稀硫酸反应,生成氢气2.8L(标准状况),原三种金属的总物质的量(单位mol)可能是( )
| A. | 0.125 | B. | 0.10 | C. | 0.08 | D. | 0.20 |
3.下列储存药品的方法中,正确的是( )
| A. | 氢氧化钠溶液盛装在玻璃塞的试剂瓶中 | |
| B. | 新制氯水保存在无色广口瓶中 | |
| C. | 铝片密封保存在细口瓶中 | |
| D. | 金属钠保存在煤油中 |
 +4Cu(OH)2+2NaOH$\stackrel{△}{→}$NaOOCCH(CH3)COONa+2Cu2O↓+6H2O.
+4Cu(OH)2+2NaOH$\stackrel{△}{→}$NaOOCCH(CH3)COONa+2Cu2O↓+6H2O.