题目内容
10.下列粒子与NH4+的质子总数和电子总数相同的是( )| A. | F- | B. | Ne | C. | H3O+ | D. | NH2- |
分析 根据微粒中质子数为各原子的质子数之和,若微粒为分子或原子,质子数=电子数;若微粒为阳离子,电子数=质子数-电荷数;若微粒为阴离子,电子数=质子数+电荷数.
解答 解:NH4+的质子数为11,电子数为10;
A.F-的质子数为9,电子数为10,故A错误;
B.Ne的质子数为10,电子数为10,故B错误;
C.H3O+的质子数为11,电子数为10,故C正确;
D.NH2-的质子数为9,电子数为10,故D错误.
故选C.
点评 本题考查电子总数和质子总数的判断,难度不大,要注意粒子中电子总数和质子总数的关系,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
相关题目
20.25°C时,某化学实验小组同学向用大理石和稀盐酸制备CO2后的残留液中滴加碳酸钠溶液,在溶液中插入pH传感器,测得pH变化曲线如图所示.下列说法不正确的是( )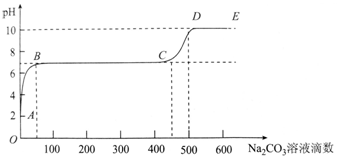

| A. | 开始时溶液pH=2是因为残留液中还有盐酸剩余 | |
| B. | BC段表示随着碳酸钠溶液的滴入,CaCO3沉淀的质量逐渐增加 | |
| C. | 滴入500滴碳酸钠溶液后溶液中c(OH-)>c(H+) | |
| D. | AB发生的反应为:Ca2++CO32-═CaCO3↓ |
1.H++OH-=H2O表示下列哪组离子反应( )
| A. | Cu(OH)2与H2SO4 | B. | Ba(OH)2与H2SO4 | C. | Ba(OH)2与HCl | D. | KHSO4与Ba(OH)2 |
18.在100mLHNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6mol/L,向该溶液中加入足量的铜粉,加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为(反应前后溶液体积变化忽略不计)( )
| A. | 0.025 mol/L | B. | 0.30mol/L | C. | 0.36mol/L | D. | 0.45mol/L |
5.长期吸食或注射毒品会严重危及人体健康.下列各组物质都属于毒品的是( )
| A. | 冰毒、黄连素 | B. | 海洛因、麻黄碱 | C. | 大麻、摇头丸 | D. | 黄曲霉素、尼古丁 |
15.下列状态的物质,既能导电又属于电解质的是( )
| A. | 盐酸 | B. | NH3 | C. | 熔融的Al2O3 | D. | BaSO4晶体 |
2.下列有机物命名正确的是( )
| A. |  | B. | CH3CH2CH2CH2OH 1-丁醇 | ||
| C. |  | D. |  |
16.研究发现,火力发电厂释放出的尾气是造成雾霾的主要原因之一,CO是其主要成分之一,为减少对环境造成的影响,发电厂试图采用以下方法将CO进行合理利用,以获得重要工业产品.
(1)CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)△H=a kJ/mol反应过程中测定的部分数据如下表:
①反应0~2min末的平均速率v(COCl2)=0.1mol/(L?min).
②在2min~4min间,v(Cl2)正=v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=5.
(2)在恒温恒容条件下关于反应CO(g)+Cl2?COCl2(g),下列说法中正确的是CD(填序号).
A.增大压强能使该反应速率加快,是因为增加了活化分子的百分数.
B.使用合适的催化剂可以增大反应体系中COCl2的体积分数
C.若改变某个反应条件,反应体系中COCl2的含量不一定增大
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡.
(3)用CO和H2在高温下合成C5H12(汽油的一种成分).已知5CO(g)+11H2(g)?C5H12(g)+5H2O(g)△H<0,若X、L分别代表温度或压强,图(1)表示L一定时,CO的转化率随X的变化关系,则C代表的物理量是温度,判断理由是该反应正反应为放热反应,由图中信息知,升高温度,平衡逆向移动,CO的转化率减小,所以X代表的物理量为温度.
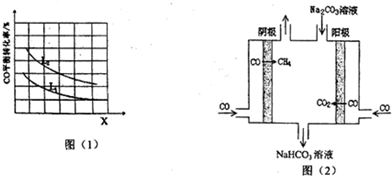
(4)工业上用CO通过电解法制备CH4,电解池的工作原理如图(2)所示,其阳极的电极反应式为CO+CO3 2-+H2O-2e-=2HCO3-;若每生成1mol CH4,理论上需要消耗CO的物质的量为4mol.
(1)CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)△H=a kJ/mol反应过程中测定的部分数据如下表:
| t/min | n (CO)/mol | n (Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.20 | |
| 4 | 0.80 |
②在2min~4min间,v(Cl2)正=v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=5.
(2)在恒温恒容条件下关于反应CO(g)+Cl2?COCl2(g),下列说法中正确的是CD(填序号).
A.增大压强能使该反应速率加快,是因为增加了活化分子的百分数.
B.使用合适的催化剂可以增大反应体系中COCl2的体积分数
C.若改变某个反应条件,反应体系中COCl2的含量不一定增大
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡.
(3)用CO和H2在高温下合成C5H12(汽油的一种成分).已知5CO(g)+11H2(g)?C5H12(g)+5H2O(g)△H<0,若X、L分别代表温度或压强,图(1)表示L一定时,CO的转化率随X的变化关系,则C代表的物理量是温度,判断理由是该反应正反应为放热反应,由图中信息知,升高温度,平衡逆向移动,CO的转化率减小,所以X代表的物理量为温度.

(4)工业上用CO通过电解法制备CH4,电解池的工作原理如图(2)所示,其阳极的电极反应式为CO+CO3 2-+H2O-2e-=2HCO3-;若每生成1mol CH4,理论上需要消耗CO的物质的量为4mol.
17. 一定温度下,卤化银AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲线如图示.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列说法正确的是( )
一定温度下,卤化银AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲线如图示.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列说法正确的是( )
 一定温度下,卤化银AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲线如图示.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列说法正确的是( )
一定温度下,卤化银AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲线如图示.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列说法正确的是( )| A. | a点表示c(Ag+)=c(CrO42-) | |
| B. | b点可表示AgI的饱和溶液 | |
| C. | 该温度下AgI的Ksp约为1×10-16 | |
| D. | 该温度下AgCl、AgBr饱和溶液中:c(Cl-)<c(Br-) |