题目内容
1.H++OH-=H2O表示下列哪组离子反应( )| A. | Cu(OH)2与H2SO4 | B. | Ba(OH)2与H2SO4 | C. | Ba(OH)2与HCl | D. | KHSO4与Ba(OH)2 |
分析 H++OH-=H2O可以表示可溶性强酸或者可溶性强酸的酸式盐与可溶性强碱反应生成可溶性盐和水,据此判断解答.
解答 解:A.氢氧化铜为沉淀,应保留化学式,所以不能用H++OH-=H2O表示,故A错误;
B.Ba(OH)2与H2SO4除了反应生成水,还生成硫酸钡沉淀,所以不能用H++OH-=H2O表示,故B错误;
C.Ba(OH)2与HCl反应实质氢离子与氢氧根离子反应生成水,离子方程式:H++OH-=H2O,故C正确;
D.KHSO4与Ba(OH)2除了氢离子与氢氧根离子反应生成水,钡离子与硫酸根离子反应生成硫酸钡沉淀,不能用H++OH-=H2O表示,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意化学式的拆分,题目难度不大.

练习册系列答案
相关题目
11.合成氨原料气H2可通过CO和水蒸气在一定条件下反应制得.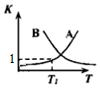
(1)已知CO和H2的燃烧热分别是283.0kJ/mol、285.8kJ/mol,lg液态水变成水蒸气时要吸收2.44kJ的热量;则该反应的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.12kJ/mol;.
(2)该反应随温度升高正、逆反应平衡常数的变化曲线如图所示,表示K正的曲线为B(选填“A”或“B”),理由是正反应为放热反应,升高温度,平衡向逆向移动,K值减小.
(3)T1℃时,向容积固定为5L的容器中充入2mol水蒸气和3molCO,发生上述反应达平衡,则平衡时水蒸气的转化率是60%(填字母)
(4)保持温度为T1℃,改变水蒸气和CO的初始物质的量之比,充入恒容容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填字母)
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a molH2
d.混合气中 n(CO):n(H2O):n(CO2):n(H2)=9:4:6:6
(5)某工业合成氨的原料气组成为:H240%、N220%、CO30%、CO210% (均为体积分数).向上述原料气中加入水蒸气,以除去其中的CO.己知不同温度下的反应物投料比[$\frac{n({H}_{2}0)}{n(C0)}$],平衡时混合气体中CO的体积分数如表所示:
①T2、T3、T4的大小关系为T2<T3<T4,判断的理由是该反应正向为放热反应,在其他条件不变的条件下,升高温度,平衡逆向移动,CO的体积分数会增大,所以T2<T3<T4.
②维持温度不变,若要使CO的转化率升高,可以改变的条件是加水/增大H2O和CO投料比/减小生成物浓度(分离出产物).
③温度为T3℃、$\frac{n({H}_{2}0)}{n(C0)}$=1时,变换后的平衡混合气体中H2的体积分数是47.8%.

(1)已知CO和H2的燃烧热分别是283.0kJ/mol、285.8kJ/mol,lg液态水变成水蒸气时要吸收2.44kJ的热量;则该反应的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.12kJ/mol;.
(2)该反应随温度升高正、逆反应平衡常数的变化曲线如图所示,表示K正的曲线为B(选填“A”或“B”),理由是正反应为放热反应,升高温度,平衡向逆向移动,K值减小.
(3)T1℃时,向容积固定为5L的容器中充入2mol水蒸气和3molCO,发生上述反应达平衡,则平衡时水蒸气的转化率是60%(填字母)
(4)保持温度为T1℃,改变水蒸气和CO的初始物质的量之比,充入恒容容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填字母)
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a molH2
d.混合气中 n(CO):n(H2O):n(CO2):n(H2)=9:4:6:6
(5)某工业合成氨的原料气组成为:H240%、N220%、CO30%、CO210% (均为体积分数).向上述原料气中加入水蒸气,以除去其中的CO.己知不同温度下的反应物投料比[$\frac{n({H}_{2}0)}{n(C0)}$],平衡时混合气体中CO的体积分数如表所示:
| CO体积分数% 投料比 | 温度/℃ | ||||
| 200 | T2 | T3 | T4 | ||
| $\frac{n({H}_{2}0)}{n(C0)}$ | 1 | 1.70 | 2.73 | 6.00 | 7.85 |
| 3 | 0.21 | 0.30 | 0.84 | 1.52 | |
| 5 | 0.02 | 0.06 | 0.43 | 0.80 | |
②维持温度不变,若要使CO的转化率升高,可以改变的条件是加水/增大H2O和CO投料比/减小生成物浓度(分离出产物).
③温度为T3℃、$\frac{n({H}_{2}0)}{n(C0)}$=1时,变换后的平衡混合气体中H2的体积分数是47.8%.
12.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | 无色溶液:Al3+、Na+、Cl-、HCO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NH4+、Fe3+、NO3- | |
| C. | FeCl3溶液:K+、Na+、NO3-、SCN- | |
| D. | 由水电离出的C(H+)=10-13mol/L的溶液:Na+、K+、SiO32-、NO3- |
9.进行化学实验时应强化安全意识.下列做法正确的是( )
| A. | 酒精着火时应立即用水灭火 | |
| B. | 实验室制蒸馏水时应在蒸馏烧瓶中放入几粒碎瓷片 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 用试管加热碳酸氢钠固体时使试管口竖直向上 |
6.镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的关系说法正确的是( )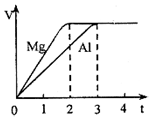

| A. | 物质的量之比为3:2 | B. | 质量之比为3:4 | ||
| C. | 摩尔质量之比为9:8 | D. | 体积之比为2:3 |
10.下列粒子与NH4+的质子总数和电子总数相同的是( )
| A. | F- | B. | Ne | C. | H3O+ | D. | NH2- |