题目内容
17.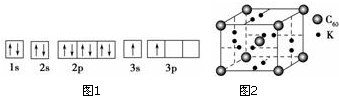 纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B的单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B的单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:| 电离能/(kJ•mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(2)ACl2分子中A原子的杂化类型为sp杂化.
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.已知金刚石中的C-C键的键长大于C60中C-C键的键长,有同学据此认为C60的熔点高于金刚石,你认为是否正确否(填“是”或“否”),并阐述理由C60为分子晶体,熔化时破坏的是分子间作用力,无需破坏共价键.
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.写出基态钾原子的价电子排布式4S1,该物质的K原子和C60分子的个数比为3:1.
(5)继C60后,科学家又合成了Si60、N60等,C、Si、N元素的电负性由大到小的顺序是N>C>Si,NCl3分子的VSEPR模型为正四面体.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则一个Si60分子中π键的数目为30.
分析 (1)由图1电子轨道排布图可知,3s能级未填满就填充3p能级,3s能级能量比3p能级低,违背了能量最低原理;
(2)BeCl2分子中Be的成2个σ键,杂化轨道数为2,采取sp杂化;
(3)C60是分子晶体,金刚石是原子晶体,决定二者熔沸点的作用力不同;
(4)钾元素位于第四周期ⅠA族,据此写出钾元素价电子排布式;利用均摊法确定K原子和C60分子的个数比;
(5)根据电负性递变规律判断电负性大小;根据价电子对互斥理论确定微粒的理论模型;每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,即形成三条共价键外,还形成一条π键,据此判断π键的数目.
解答 解:(1)①由图1电子轨道排布图可知,3s能级未填满就填充3p能级,所以违背能量最低原理,
故答案为:能量最低原理;
(2)BeCl2分子中Be的成2个σ键,杂化轨道数为2,采取sp杂化,
故答案为:sp杂化;
(3)C60是分子晶体,金刚石是原子晶体,决定二者熔沸点的作用力不同,C60为分子晶体,熔化时破坏的是分子间作用力,无需破坏共价键
,所以认为C60的熔点高于金刚石是错误的,
故答案为:否; C60为分子晶体,熔化时破坏的是分子间作用力,无需破坏共价键;
(4)钾元素位于第四周期ⅠA族,写出钾元素价电子排布式为4S1;该晶胞中C60个数=1+8×$\frac{1}{8}$=2,6×2×$\frac{1}{2}$=6,所以K原子和C60分子的个数比为6:2=3:1,
故答案为:4S1;3:1;
(5)电负性同周期从左到右,逐渐增大,同主族从上到下,逐渐减小,则电负性由大到小顺序为:N>C>Si;
NCl3中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{5-3×1}{2}$=4,所以原子杂化方式是sp3,价层电子对互斥理论模型为为正四面体构型;
Si60分子中,共价键数目为60×3×$\frac{1}{2}$=90,每三条共价键含有一条π键,数目为:90×$\frac{1}{3}$=30,
故答案为:N>C>Si;正四面体;30.
点评 本题考查了位置、结构和性质的关系,题目难度中等,涉及晶胞的计算、电子排布图、杂化类型判断、电负性等知识点,试题知识点较多,充分考查了学生灵活应用基础知识的能力,要求学生能够运用均摊法计算化学键、晶胞的化学式.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1,则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1.
(2)CO与O2设计成燃料电池(以KOH溶液为电解液).该电池的负极反应式为CO+4OH--2e-=CO32-+2H2O.
(3)CO2和H2充入一定体积的恒容密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.
①该反应的△H小于0(填“大于或小于”),曲线I、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>、=或<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、3a mol H2、 b mol CH3OH(g)、b mol H2O(g) |
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2,在0~15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为Ⅱ>Ⅲ>Ⅰ(填序号).
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图3.
①当温度在300℃~400℃范围时,温度是乙酸生成速率的主要影响因素;
②Cu2Al2O4可溶于稀硝酸,稀硝酸还原产物为NO,写出有关的离子方程式3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
| A. | 将煤通过物理变化液化后再作为能源,可减少PM2.5引起的危害 | |
| B. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 | |
| C. | 普通玻璃属于无机非金属材料,有机玻璃属于新型无机非金属材料 | |
| D. | 氟氯烃是安全、环保的制冷剂 |
(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
已知:2C (s)+O2(g)?2CO(g)△H=-221.0KJ/mol
C (s)+O2(g)?CO2(g)△H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1.
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
A.4.20 B.4.00 C.2.95 D.2.80
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| iii | 900 | a | b | c | d | t |
(4)二甲醚是清洁能源,用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、
投料比$\frac{n({H}_{2})}{n(CO)}$的变化曲线如图1所示.
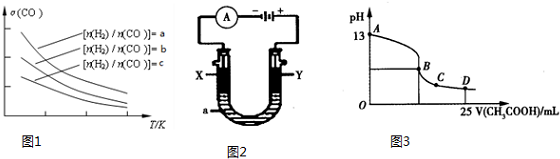
①a、b、c按从大到小的顺序排序为a>b>c.
②根据图象可以判断该反应为放热反应,理由是投料比相同,温度越高CO的转化率越低,平衡向左移动,推得该反应为放热反应.
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-.
①则负极的电极反应式为CO+2O2--2e-=CO32-.
②以上述电池为电源,通过导线连接成图2.若X、Y为石墨,a为2L 0.1mol/L KCl溶液电解一段时间后,取25mL 上述电解后的溶液,滴加0.4mol/L醋酸得到图3曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).根据图二计算,上述电解过程中 消耗一氧化碳的质量为2.8g.
| A. | NaHCO3溶液显弱酸性 | |
| B. | 该溶液中K+、Al3+、H+、SO${\;}_{4}^{2-}$可以大量共存 | |
| C. | 加水稀释该溶液,溶液中$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| D. | 向该溶液中加入足量的氢氧化钙溶液的离子方程式为:2HCO${\;}_{3}^{-}$+Ca2++2OH-═CaCO3↓+CO${\;}_{3}^{2-}$+2H2O |
 ;
; .
.

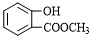 .
.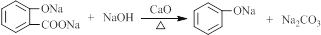 .
.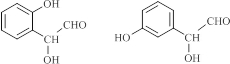 (写结构简式).
(写结构简式). .固体甲溶于水后,溶液呈碱(酸、碱或中性),写出甲与水反应的化学方程式NH5+H2O=NH3•H2O+H2↑.
.固体甲溶于水后,溶液呈碱(酸、碱或中性),写出甲与水反应的化学方程式NH5+H2O=NH3•H2O+H2↑.


