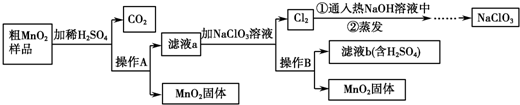
题目内容
6.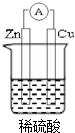 若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答:
若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答:(1)原电池是一种将化学能转化为电能的装置.
(2)Zn板作负 极,发生氧化反应,电极反应式:Zn-2e-=Zn2+.
分析 Zn、Cu、稀硫酸构成的原电池中,化学能转化为电能,锌易失电子作负极,铜作正极,负极上发生氧化反应,正极上发生还原反应,以此解答该题.
解答 解:(1)原电池为化学能转化为电能的装置,故答案为:化学;电;
(2)该原电池中,Zn易失电子发生氧化反应而作负极,铜作正极,正极上 得电子发生还原反应,负极上锌失电子生成锌离子,正极上氢离子得电子生成氢气,所以电极反应式分别为:Zn-2e-═Zn2+、2H++2e-=H2↑,
故答案为:负;氧化;Zn-2e-=Zn2+.
点评 本题考查了原电池原理,明确电极上得失电子及电极反应是解本题关键,根据电极上得失电子确定正负极,难点是电极反应式的书写,注意结合电解质溶液酸碱性书写.

练习册系列答案
相关题目
14.下列实验或现象中,可证明胶体粒子带电荷的是( )
| A. | 电泳 | B. | 丁达尔效应 | C. | 布朗运动 | D. | 渗析 |
11.向纯水中加入少量NaHSO4固体,当温度不变时,则该溶液中( )
| A. | 水电离出的c(H+) 减小 | B. | c(OH-) 与 c(H+) 的乘积增大 | ||
| C. | c(H+ ) 减小 | D. | c(OH-) 增大 |
18.铝在人体内积累可使人慢性中毒,引起老年痴呆症.世界卫生组织将铝确定为“食品污染源”之一而加以控制.铝的下列应用中无须控制的是( )
| A. | 铝制电线电缆 | B. | 铝制餐具 | C. | 铝制可乐易拉罐 | D. | 糖果内包装 |
15.下列说法中正确的是( )
| A. | 氯水应该盛放在棕色的广口瓶中 | |
| B. | 某溶液中加入CCl4后显紫色,证明溶液中有I- | |
| C. | 能使湿润的淀粉碘化钾试纸变蓝的气体一定是氯气 | |
| D. | 某溶液中滴加BaCl2溶液后有白色沉淀生成,加入稀盐酸后沉淀不消失,则该溶液中可能有Ag+或SO42- |
16.元素周期表的形式多种多样,如下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,下列说法正确的是( )

| A. | ②、⑧、⑨对应简单离子半径依次减小 | |
| B. | ⑤的三种核素化学性质不同 | |
| C. | 元素=10 ⑩处于常见周期表第四周期第VIIIB族 | |
| D. | ④的最高价氧化物对应的水化物能与其氢化物反应,生成离子化合物 |
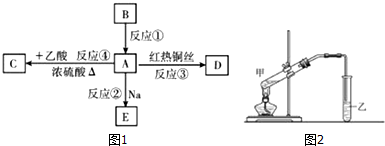
 .D的物质的名称是乙醛.
.D的物质的名称是乙醛. 反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势如图所示:
反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势如图所示: