题目内容
11.向纯水中加入少量NaHSO4固体,当温度不变时,则该溶液中( )| A. | 水电离出的c(H+) 减小 | B. | c(OH-) 与 c(H+) 的乘积增大 | ||
| C. | c(H+ ) 减小 | D. | c(OH-) 增大 |
分析 NaHSO4固体在水中完全电离生成Na+、H+和SO42-,向水中加入硫酸氢钠固体相当于加入强酸溶液,抑制水电离,水的离子积常数只与温度有关,据此分析解答.
解答 解:A.NaHSO4固体在水中完全电离生成Na+、H+和SO42-,向水中加入硫酸氢钠固体相当于加入强酸溶液,抑制水电离,水电离出的c(H+) 减小,故A正确;
B.水的离子积常数只与温度有关,温度不变,水的离子积常数不变,则溶液中c(OH-) 与 c(H+) 的乘积不变,故B错误;
C.硫酸氢钠电离出的氢离子导致溶液中c(H+)增大,故C错误;
D.温度不变,水的离子积常数不变,溶液中c(H+)增大导致c(OH-)减小,故D错误;
故选A.
点评 本题考查弱电解质的电离,为高频考点,明确影响水电离因素是解本题关键,侧重考查学生分析判断能力,注意:离子积常数只与温度有关,注意:该溶液中c(OH-) 与 c(H+) 的乘积不变,但该溶液中水电离出的c(OH-) 与 c(H+) 的乘积减小,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.下列微粒中,碳原子都满足最外层为8电子结构的是( )
| A. | 乙基(-CH2CH3) | B. | 碳正离子[(CH3)3C+] | C. | 乙炔 (C2H2) | D. | 羧基 (-COOH) |
16.下列离子方程式书写正确的是( )
| A. | 铜和稀硝酸反应 Cu+4H++NO3-=Cu2++2H2O+NO↑ | |
| B. | 碳酸氢钠的水解 HCO3-+H2O?CO32-+H3O+ | |
| C. | Fe投入盐酸中 2Fe+6H+=2Fe3++3H2↑ | |
| D. | 氢氧化铝溶于氢氧化钠溶液 Al(OH)3+OH-=AlO2-+2H2O |
3.下列反应中,属于取代反应的是( )
| A. | CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3-CH2OH | B. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | ||
| C. | CH4$\stackrel{高温}{→}$C+2H2 | D. | CH≡CH+HCl$→_{△}^{催化剂}$CH2═CHCl |
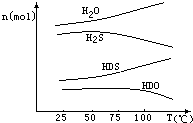 我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg•L-1.其工业提取法有:
我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg•L-1.其工业提取法有: 图示中,E是不溶于水的白色胶状物质.
图示中,E是不溶于水的白色胶状物质.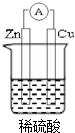 若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答:
若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答: +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$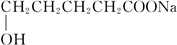 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.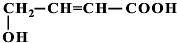 、
、 、
、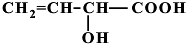 (提示:羟基不能连在碳碳双键上).
(提示:羟基不能连在碳碳双键上).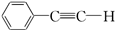 .
.