题目内容
16.A是常见的有机物质,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平.有关物质的转化关系如图1所示,请回答下列问题:
(1)B的结构式为
 .D的物质的名称是乙醛.
.D的物质的名称是乙醛.(2)在①~④反应中,属于加成反应的是①(填反应序号).
(3)写出下列反应的化学方程式:
反应①CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH;反应②2C2H5OH+2Na→2C2H5ONa+H2↑;反应③2C2H5OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(4)实验室用如图2所示装置进行反应④.
a.反应④的化学方程式是C2H5OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
b.试管乙中应加入,乙中的导管不能伸入到液面下的原因是饱和碳酸钠溶液或饱和Na2CO3溶液;防止倒吸.
c.实验完成后,从试管乙中分离出有机物C的方法是振荡、静置、分液.
分析 B的产量可衡量一个国家石油化工发展的水平,则B是CH2=CH2;
A是常见的有机物质,它易溶于水并有特殊香味;A能和铜丝反应生成D,A能和乙酸反应生成C,A能和钠反应生成E,则A为CH3CH2OH,C为CH3COOCH2CH3,D为CH3CHO,E为CH3CH2ONa,再结合题目分析解答.
解答 解:B的产量可衡量一个国家石油化工发展的水平,则B是CH2=CH2;A是常见的有机物质,它易溶于水并有特殊香味;A能和铜丝反应生成D,A能和乙酸反应生成C,A能和钠反应生成E,则A为CH3CH2OH,C为CH3COOCH2CH3,D为CH3CHO,E为CH3CH2ONa,
(1)B是乙烯,其结构式为 ,D是乙醛,故答案为:
,D是乙醛,故答案为: ;乙醛;
;乙醛;
(2)在①~④反应中,属于加成反应的是①,故答案为:①;
(3)反应①可由乙烯与水发生加成反应生成乙醇,方程式为CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,
反应②为乙醇和钠的反应,反应方程式为:2C2H5OH+2Na→2C2H5ONa+H2↑;
反应③为乙醇的催化氧化反应,反应方程式为:2C2H5OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH;2C2H5OH+2Na→2C2H5ONa+H2↑;2C2H5OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(4)a.该反应是乙酸乙酯的制取,反应方程式为C2H5OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,
故答案为:C2H5OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
b.实验室用饱和碳酸钠溶液制取乙酸乙酯,所以乙中盛放的是饱和碳酸钠溶液或饱和Na2CO3溶液,乙中的导管不能伸入到液面下的原因是防止倒吸,
故答案为:饱和碳酸钠溶液或饱和Na2CO3溶液;防止倒吸;
c.乙酸乙酯难溶于水,可以采用分液方法分离,其分离方法为振荡、静止、分液,故答案为:振荡、静置、分液.
点评 本题考查有机物推断,为高频考点,涉及烯烃、醇、醛、羧酸、酯的转化,根据物质性质及反应条件进行推断,知道乙酸乙酯的制取方法.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 该反应中,生成物的总能量大于反应物的总能量 | |
| B. | 该反应中,断裂化学键会放出能量 | |
| C. | 乙醇的燃烧热为683.4KJ/mol | |
| D. | 反应$\frac{1}{2}$C2H5OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+$\frac{3}{2}$H2O(g)△H>-683.4KJ/mol |
| A. | 标准状态下,2.24LCl2中含有的共价键数 | |
| B. | 100g质量分数为16.2%HBr溶液中的氢原子数 | |
| C. | 3.9gNa2O2晶体中所含的离子总数 | |
| D. | 0.1molH2S和0.1molSO2混合后,体系中的硫原子数 |
| A. | 乙基(-CH2CH3) | B. | 碳正离子[(CH3)3C+] | C. | 乙炔 (C2H2) | D. | 羧基 (-COOH) |
| A. | MgCl2 | B. | CH3COOH | C. | KOH | D. | HNO3 |
 最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO+H2O$\frac{\underline{\;电解\;}}{\;}$CH3CH2OH+CH3COOH
最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO+H2O$\frac{\underline{\;电解\;}}{\;}$CH3CH2OH+CH3COOH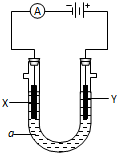 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连. 请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连. 请回答以下问题: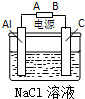 甲、乙、丙三位同学按下列方法制取氢氧化铝,请你参与并回答有关问题.
甲、乙、丙三位同学按下列方法制取氢氧化铝,请你参与并回答有关问题.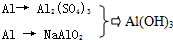
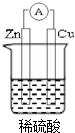 若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答:
若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答: