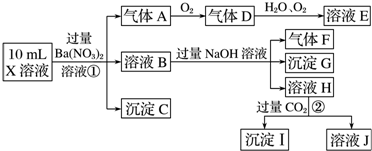
题目内容
16.元素周期表的形式多种多样,如下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,下列说法正确的是( )
| A. | ②、⑧、⑨对应简单离子半径依次减小 | |
| B. | ⑤的三种核素化学性质不同 | |
| C. | 元素=10 ⑩处于常见周期表第四周期第VIIIB族 | |
| D. | ④的最高价氧化物对应的水化物能与其氢化物反应,生成离子化合物 |
分析 由元素在周期表中的位置可知,①为H、②为Na、③为C、④为N、⑤为O、⑥为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Fe,
A.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大;
B.同素异形体,化学性质相同,物理性质不同;
C.元素⑩处于常见周期表第四周期第VⅢ族;
D.的最高价氧化物对应的水化物是硝酸,与氢化物氨气反应可以形成离子化合物NH4NO3.
解答 解:由元素在周期表中的位置可知,①为H、②为Na、③为C、④为N、⑤为O、⑥为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Fe,
A.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->Cl->Na+,故A错误;
B.同素异形体,化学性质相同,物理性质不同,则氧的三种核素化学性质不同,故B错误;
C.元素⑩处于常见周期表第四周期第VⅢ族,故C错误;
D.的最高价氧化物对应的水化物是硝酸,与氢化物氨气反应可以形成离子化合物NH4NO3,分子中都含有极性键、离子键,是离子化合物,故D正确.
故选D.
点评 本题考查元素周期表的结构及应用,为高频考点,把握扇形元素周期表与常见元素周期表的关系为解答的关键,注意D选项中是离子化合物,题目难度不大.

练习册系列答案
相关题目
8.有三个放热反应:
①2H2(g)+O2(g)=2H2O(g)+Q1kJ;
②2H2(g)+O2(g)=2H2O(l)+Q2kJ;
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)+Q3kJ;
其中放出热量Q1、Q2、Q3的大小关系为( )
①2H2(g)+O2(g)=2H2O(g)+Q1kJ;
②2H2(g)+O2(g)=2H2O(l)+Q2kJ;
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)+Q3kJ;
其中放出热量Q1、Q2、Q3的大小关系为( )
| A. | Q1=Q2=Q3 | B. | Q3<Q1<Q2 | C. | Q3<Q2<Q1 | D. | Q1<Q2<2Q3 |
6.下列离子方程式正确的是( )
| A. | 向溴水中通入适量的SO2:Br2+SO2+2H2O═2Br-+SO${\;}_{4}^{2-}$+4H+ | |
| B. | 用铜作电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 向明矾溶液中滴加过量氨水:Al3++4NH3•H2O═AlO${\;}_{2}^{-}$+4NH${\;}_{4}^{+}$+2H2O | |
| D. | 向小苏打溶液中加少量Ba(OH)2溶液:HCO${\;}_{3}^{-}$+Ba2++OH-═BaCO3↓+H2O |
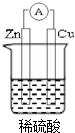 若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答:
若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答: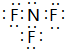 ;
; +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$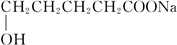 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.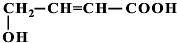 、
、 、
、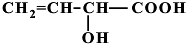 (提示:羟基不能连在碳碳双键上).
(提示:羟基不能连在碳碳双键上).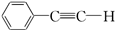 .
.