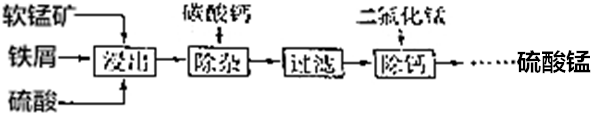
题目内容
4.下列是含碳元素的物质:①石墨②一氧化碳③干冰④碳酸⑤碳酸钙⑥乙醇.其中属于单质的是①(填序号,下同);属于酸性氧化物的是③;属于盐的是⑤,属于酸的是④;属于有机物的是⑥.分析 只有碳元素一种元素组成的是单质;
能与碱反应生成盐和水的是酸性氧化物;
由金属离子与酸根离子构成的是盐;
水溶液中电离出的阳离子全部是氢离子的化合物为酸;
一般含碳元素的化合物为有机物,但不包括一氧化碳、二氧化碳与碳酸盐等.
解答 解:碳元素组成的物质很多,有单质和化合物,在下列物质中:
①石墨是一种元素组成的为单质;
②一氧化碳是氧化物,不与碱反应,属于不成盐氧化物;
③干冰是二氧化碳,和碱反应生成盐和水,属于酸性氧化物;
④碳酸水溶液中电离出的阳离子全部是氢离子,属于酸;
⑤碳酸钙是钙离子和碳酸根离子构成的化合物属于盐;
⑥乙醇是烃的衍生物,属于有机物;
所以属于单质的是 ①;属于酸性氧化物的是 ③;属于盐的是⑤; 属于酸的是④;属于有机物的是 ⑥.
故答案为:①;③;⑤;④;⑥.
点评 本题考查物质分类方法,物质组成的判断,注意单质和化合物的区别,明确化合物的不同类别,题目较简单.

练习册系列答案
相关题目
15.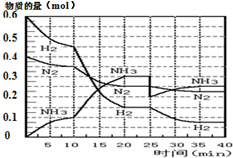 氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
回答下列问题:
(1)10min内以NH3表示的平均反应速率0.005mol/(L.min);
(2)在10~20min内:NH3浓度变化的原因可能是A;
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为:20-25min,第1次平衡:平衡常数K1=$\frac{(\frac{0.3mol}{2L})^{2}}{(\frac{0.25mol}{2L})({\frac{0.15mol}{2L})}^{3}}$(带数据的表达式),
(4)在反应进行至25min时:
①曲线发生变化的原因:分离出0.1molNH3
②达第二次平衡时,新平衡的平衡常数K2等于 K1(填“大于”、“等于”、“小于”);
(5)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g)+3H2O(1)?2NH3(g)+$\frac{3}{2}$O2(g);△H=a kJ•mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
①此合成反应的a>0;△S>0,(填“>”、“<”或“=”)
②已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)=2H2O(l)=-571.6kJ•mol-1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1536kJ•mol-1.
 氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.回答下列问题:
(1)10min内以NH3表示的平均反应速率0.005mol/(L.min);
(2)在10~20min内:NH3浓度变化的原因可能是A;
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为:20-25min,第1次平衡:平衡常数K1=$\frac{(\frac{0.3mol}{2L})^{2}}{(\frac{0.25mol}{2L})({\frac{0.15mol}{2L})}^{3}}$(带数据的表达式),
(4)在反应进行至25min时:
①曲线发生变化的原因:分离出0.1molNH3
②达第二次平衡时,新平衡的平衡常数K2等于 K1(填“大于”、“等于”、“小于”);
(5)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g)+3H2O(1)?2NH3(g)+$\frac{3}{2}$O2(g);△H=a kJ•mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
②已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)=2H2O(l)=-571.6kJ•mol-1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1536kJ•mol-1.
19.常温时,某溶液中由水电离出的H+和OH-的物质的量浓度乘积为1×10-10,则该溶液可能是( )
①H2SO4;②CH3COOH;③NH4Cl;④KOH;⑤CH3COONa.
①H2SO4;②CH3COOH;③NH4Cl;④KOH;⑤CH3COONa.
| A. | ①④⑤ | B. | ③ | C. | ①②③ | D. | ③⑤ |
16.设反应C+CO2?2CO△H>0,反应速率为v1;平衡常数为K1;N2+3H2?2NH3 △H<0,反应速率为v2,平衡常数为K2.对于上述反应,当温度升高时,v1、v2、K1、K2的变化情况为( )
| A. | v1、v2、K1、K2同时增大 | B. | v1、v2、K1、K2同时减小 | ||
| C. | v1、v2增大,K1增大,K2减小 | D. | v2减小,v1增大,K1增大,K2减小 |
13.已知某气体的摩尔质量为M,一定条件下的摩尔体积为Vm,下列说法正确的是( )
| A. | 一个该气体分子的质量为M/NA | |
| B. | 一个该气体分子的体积为Vm/NA | |
| C. | 气体摩尔体积的大小取决于气体分子本身的大小 | |
| D. | 上述说法均不正确 |
 H2S:
H2S: Na2O2:
Na2O2: .
.