题目内容
如图是部分短周期主族元素原子半径与原子序数的关系图.下列说法正确的是( )
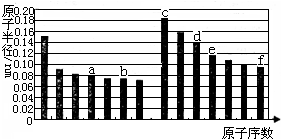

| A、a的单质在高温条件下能置换出e的单质,说明非金属性a<e |
| B、b、d两种元素的离子半径相比,前者较大 |
| C、由b、e两种元素组成的化合物能溶解于强碱溶液,但不能与酸溶液反应 |
| D、由c、d分别与f组成的化合物中的化学键类型相同 |
考点:元素周期律的作用
专题:元素周期律与元素周期表专题
分析:同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,a为碳元素,b为氧元素,c为钠元素,d为Al元素,e为Si元素,f为Cl元素,依此进行判断.
解答:
解:同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,a为碳元素,b为氧元素,c为钠元素,d为Al元素,e为Si元素,f为Cl元素,
A.同一主族,从上往下,非金属性逐渐减弱,故非金属性a>e,故A错误;
B.氧离子与铝离子的电子层数相同,核电荷数越小,离子半径越大,故离子半径:氧离子>铝离子,故B正确;
C.氧元素与硅元素下次的化合物是二氧化硅,二氧化硅能与氢氧化钠反应,也能与氢氟酸反应,故C错误;
D.钠元素与氯元素组成的化合物是氯化钠,含有离子键;铝元素与氯元素组成的化合物是氯化铝,含有共价键,故D错误;
故选B.
A.同一主族,从上往下,非金属性逐渐减弱,故非金属性a>e,故A错误;
B.氧离子与铝离子的电子层数相同,核电荷数越小,离子半径越大,故离子半径:氧离子>铝离子,故B正确;
C.氧元素与硅元素下次的化合物是二氧化硅,二氧化硅能与氢氧化钠反应,也能与氢氟酸反应,故C错误;
D.钠元素与氯元素组成的化合物是氯化钠,含有离子键;铝元素与氯元素组成的化合物是氯化铝,含有共价键,故D错误;
故选B.
点评:本题考查位置结构性质的关系及应用,难度中等.了解短周期主族元素,推断出元素是解题的关键.

练习册系列答案
相关题目
下列有关物质应用的说法正确的是( )
| A、生石灰用作食品抗氧剂 |
| B、盐类都可作调味品 |
| C、铝罐可久盛食醋 |
| D、小苏打是面包发酵粉的主要成分 |
下列关于离子的叙述正确的是( )
| A、在c(H+)=1×10-13mol?L-1的溶液中:Na+、Fe3+、Cl-、SO42-能大量共存 |
| B、铜溶于FeCl3溶液中:Cu+Fe3+=Fe2++Cu2+ |
| C、NaHCO3溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D、向溶液中加入BaCl2溶液后再加盐酸,有白色沉淀,说明该溶液中一定含有SO42- |
利用如图所示联合装置制备金属钛,下列叙述正确的是( )


| A、甲装置中通入O2的电极反应式为:O2+4e-═2O2- |
| B、若不考虑能量的损失,制备24.0g金属钛,需要消耗氢气22.4 L |
| C、甲装置工作过程中pH减小 |
| D、乙装置中的石墨电极反应式为:C+2O2--4e-═CO2↑ |
 向某碳酸钠溶液中逐滴加1mol?L-1的盐酸,侧得溶液中Cl-、HCO3-的物质随加入盐酸体积的关系如图所示,则下列说法中正确的是( )
向某碳酸钠溶液中逐滴加1mol?L-1的盐酸,侧得溶液中Cl-、HCO3-的物质随加入盐酸体积的关系如图所示,则下列说法中正确的是( )| A、b点的数值为0.6 |
| B、该碳酸钠溶液中含有1molNa2CO3 |
| C、Oa段反应的离子方程式与ab段反应的离子方程式相同 |
| D、a点时加入的盐酸为0.5mol,此时生成CO2的物质的量为0.25mol |
 在含有4molHCl和1molMgSO4的混合液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如图,下列说法错误的是( )
在含有4molHCl和1molMgSO4的混合液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如图,下列说法错误的是( )| A、a→b时的沉淀的成分只有BaSO4 |
| B、b→c时发生的离子反应为:H++OH-=H2O |
| C、d点时加入的Ba(OH)2物质的量为3mol |
| D、d点后溶液离子的物质的量:Ba2+一定大于OH- |
 (1)下面所列的是中学化学实验中几种常见的仪器:
(1)下面所列的是中学化学实验中几种常见的仪器: 和CH3(CH2)3CH3⑧
和CH3(CH2)3CH3⑧ 和
和