题目内容
设NA表示阿伏加德罗常数的值,下列说法中正确的( )
①一定条件下定容容器中充入3molH2(g)和1molN2(g)发生反应:H2(g)+N2(g)?2NH3(g);△H=-QkJ/mol,当该反应放出0.25QkJ的热量时,容器中的氢分子数共有2.25NA
②常温下,21gC3H6和C4H8的混合物中含有的碳原子数为1.5NA
③14.2g硫酸钠固体中含有0.1NA个硫酸钠分子;
④2gD216O中含有的质子数、中子数、电子数均为NA
⑤标准状况下,11.2L氯仿中含有C-Cl键的数目为1.5NA
⑥将100mL0.1mol?L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA.
①一定条件下定容容器中充入3molH2(g)和1molN2(g)发生反应:H2(g)+N2(g)?2NH3(g);△H=-QkJ/mol,当该反应放出0.25QkJ的热量时,容器中的氢分子数共有2.25NA
②常温下,21gC3H6和C4H8的混合物中含有的碳原子数为1.5NA
③14.2g硫酸钠固体中含有0.1NA个硫酸钠分子;
④2gD216O中含有的质子数、中子数、电子数均为NA
⑤标准状况下,11.2L氯仿中含有C-Cl键的数目为1.5NA
⑥将100mL0.1mol?L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA.
| A、①③⑥ | B、④⑤⑥ |
| C、①②④ | D、①⑥ |
考点:阿伏加德罗常数
专题:
分析:①依据热化学方程式的定量关系计算分析,反应焓变是指对应化学方程式物质全部反应时放出的热量;
②C3H6和C4H8的最简比为CH2,只需计算21gCH2中碳原子数分析;
③硫酸钠是离子化合物不存在分子;
④依据n=
计算物质的量结合分子式计算微粒数;
⑤氯仿标准状况不是气体;
⑥胶体微粒是氢氧化铁的集合体;
②C3H6和C4H8的最简比为CH2,只需计算21gCH2中碳原子数分析;
③硫酸钠是离子化合物不存在分子;
④依据n=
| m |
| M |
⑤氯仿标准状况不是气体;
⑥胶体微粒是氢氧化铁的集合体;
解答:
解:①依据热化学方程式的定量关系计算分析,反应焓变是指对应化学方程式物质全部反应时放出的热量,一定条件下定容容器中充入3molH2(g)和1molN2(g)发生反应:3H2(g)+N2(g)?2NH3(g);△H=-QkJ/mol,当该反应放出0.25QkJ的热量时,容器中的氢分子数=(3mol-0.75mol)NA=2.25NA,故①正确;
②C3H6和C4H8的最简比为CH2,只需计算21gCH2中碳原子数=
×NA=1.5NA,故②正确;
③硫酸钠是离子化合物不存在分子,故③错误;
④依据n=
计算物质的量=
=0.1mol,结合分子式计算含有的质子数NA、中子数NA、电子数为NA,故④正确;
⑤氯仿标准状况不是气体,11.2L氯仿物质的量不是0.5mol,故⑤错误;
⑥胶体微粒是氢氧化铁的集合体,将100mL0.1mol?L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒小于0.01NA.故⑥错误;
故选C.
②C3H6和C4H8的最简比为CH2,只需计算21gCH2中碳原子数=
| 21g |
| 14g/mol |
③硫酸钠是离子化合物不存在分子,故③错误;
④依据n=
| m |
| M |
| 2g |
| 20g/mol |
⑤氯仿标准状况不是气体,11.2L氯仿物质的量不是0.5mol,故⑤错误;
⑥胶体微粒是氢氧化铁的集合体,将100mL0.1mol?L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒小于0.01NA.故⑥错误;
故选C.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是物质的量计算微粒数,热化学方程式计算,胶体的分析应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图,下列对该实验的描叙错误的是( )
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图,下列对该实验的描叙错误的是( )| A、为使受热均匀,可改用水浴加热 |
| B、长玻璃管冷凝回流作用 |
| C、提纯乙酸丁酯需要经过水、饱和碳酸钠溶液洗涤 |
| D、加入过量乙酸可以提高1-丁醇的转化率 |
已知25℃时,Mg( OH)2的溶度积常数Ksp=5.6×l0-12.取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得溶液的pH=13.0,则下列说法不正确的是( )
| A、所得溶液中的c (H+)=10-13 mol.L-1 |
| B、所得溶液中由水电离产生的c(OH -)=10-13mol.L-1 |
| C、所得溶液中的c (Mg2+)=5.6×l0-10 mol.L-1 |
| D、所加烧碱溶液的pH=13.0 |
如图是部分短周期主族元素原子半径与原子序数的关系图.下列说法正确的是( )
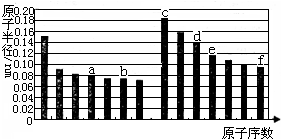

| A、a的单质在高温条件下能置换出e的单质,说明非金属性a<e |
| B、b、d两种元素的离子半径相比,前者较大 |
| C、由b、e两种元素组成的化合物能溶解于强碱溶液,但不能与酸溶液反应 |
| D、由c、d分别与f组成的化合物中的化学键类型相同 |
下列有关化学用语表示正确的是( )
| A、次氯酸的结构式:H-Cl-O |
B、O2的电子式: |
| C、葡萄糖的实验式:CH2O |
| D、能说明碳酸钙为强电解质的表达式:CaCO3(s)?Ca2+(aq)+CO32-(aq) |
下列物质中其电子式可用 表示的是( )
表示的是( )
 表示的是( )
表示的是( )| A、HClO | B、NaHS |
| C、KOH | D、KClO |
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示: 火柴头上通常含有氯酸钾、二氧化锰、硫等物质.某研究性学习小组进行火柴头中有关物质的实验探究.
火柴头上通常含有氯酸钾、二氧化锰、硫等物质.某研究性学习小组进行火柴头中有关物质的实验探究.