题目内容
 在含有4molHCl和1molMgSO4的混合液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如图,下列说法错误的是( )
在含有4molHCl和1molMgSO4的混合液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如图,下列说法错误的是( )| A、a→b时的沉淀的成分只有BaSO4 |
| B、b→c时发生的离子反应为:H++OH-=H2O |
| C、d点时加入的Ba(OH)2物质的量为3mol |
| D、d点后溶液离子的物质的量:Ba2+一定大于OH- |
考点:离子方程式的有关计算
专题:
分析:向含有4mol HCl和1mol MgSO4的混合溶液中加入Ba(OH)2溶液,
a→b时:1mol硫酸镁中含有1mol硫酸根离子,完全转化成硫酸钡沉淀需要消耗1mol氢氧化钡,说明加入1mol氢氧化钡时,硫酸根离子完全沉淀,由于溶液中存在氢离b→c时:继续加氢氧化钡,与HCl反应,2molHCl消耗1mol氢氧化钡,此时不会生成氢氧化镁沉淀,发生反应的是氢离子与氢氧根离子反应;所以沉淀的质量暂时不变;
b→c时:当加入的氢氧化钡大于2mol后,氢离子完全反应,镁离子开始与氢氧根离子反应生成氢氧化镁沉淀,当加入3mol氢氧化钡后,沉淀的质量达到最大,
d→e时:氢氧化钡过量,溶液中不再发生反应,据此分析.
a→b时:1mol硫酸镁中含有1mol硫酸根离子,完全转化成硫酸钡沉淀需要消耗1mol氢氧化钡,说明加入1mol氢氧化钡时,硫酸根离子完全沉淀,由于溶液中存在氢离b→c时:继续加氢氧化钡,与HCl反应,2molHCl消耗1mol氢氧化钡,此时不会生成氢氧化镁沉淀,发生反应的是氢离子与氢氧根离子反应;所以沉淀的质量暂时不变;
b→c时:当加入的氢氧化钡大于2mol后,氢离子完全反应,镁离子开始与氢氧根离子反应生成氢氧化镁沉淀,当加入3mol氢氧化钡后,沉淀的质量达到最大,
d→e时:氢氧化钡过量,溶液中不再发生反应,据此分析.
解答:
解:由题意可知:向含有4mol HCl和1mol MgSO4的混合溶液中加入Ba(OH)2溶液,
a→b时:1mol硫酸镁中含有1mol硫酸根离子,完全转化成硫酸钡沉淀需要消耗1mol氢氧化钡,说明加入1mol氢氧化钡时,硫酸根离子完全沉淀,由于溶液中存在氢离b→c时:继续加氢氧化钡,与HCl反应,2molHCl消耗1mol氢氧化钡,此时不会生成氢氧化镁沉淀,发生反应的是氢离子与氢氧根离子反应;所以沉淀的质量暂时不变;
b→c时:当加入的氢氧化钡大于2mol后,氢离子完全反应,镁离子开始与氢氧根离子反应生成氢氧化镁沉淀,当加入3mol氢氧化钡时,沉淀的质量达到最大,
d→e时:氢氧化钡过量,溶液中不再发生反应,
A.根据分析可知,a→b段产生的沉淀只有BaSO4,由于HCl的存在,OH-不能与Mg2+产生沉淀Mg(OH)2,故A正确;
B.b→c段表示的是氢离子与氢氧根离子反应生成水,反应的离子方程式为:H++OH-→H2O,故B正确;
C.当加入3mol氢氧化钡时,沉淀的质量达到最大,即d点时加入的Ba(OH)2物质的量为3mol,故C正确;
D.d→e时,由于加入的氢氧化钡的物质的量不确定,根据氢氧化钡的化学式可知,溶液中离子的物质的量:Ba2+可能小于OH-,有可能大于氢氧根离子,故D错误;
故选D.
a→b时:1mol硫酸镁中含有1mol硫酸根离子,完全转化成硫酸钡沉淀需要消耗1mol氢氧化钡,说明加入1mol氢氧化钡时,硫酸根离子完全沉淀,由于溶液中存在氢离b→c时:继续加氢氧化钡,与HCl反应,2molHCl消耗1mol氢氧化钡,此时不会生成氢氧化镁沉淀,发生反应的是氢离子与氢氧根离子反应;所以沉淀的质量暂时不变;
b→c时:当加入的氢氧化钡大于2mol后,氢离子完全反应,镁离子开始与氢氧根离子反应生成氢氧化镁沉淀,当加入3mol氢氧化钡时,沉淀的质量达到最大,
d→e时:氢氧化钡过量,溶液中不再发生反应,
A.根据分析可知,a→b段产生的沉淀只有BaSO4,由于HCl的存在,OH-不能与Mg2+产生沉淀Mg(OH)2,故A正确;
B.b→c段表示的是氢离子与氢氧根离子反应生成水,反应的离子方程式为:H++OH-→H2O,故B正确;
C.当加入3mol氢氧化钡时,沉淀的质量达到最大,即d点时加入的Ba(OH)2物质的量为3mol,故C正确;
D.d→e时,由于加入的氢氧化钡的物质的量不确定,根据氢氧化钡的化学式可知,溶液中离子的物质的量:Ba2+可能小于OH-,有可能大于氢氧根离子,故D错误;
故选D.
点评:本题考查了离子反应,题目难度中等,在根据物质的性质对表示变化过程的曲线进行分析时,要特别关注曲线的起点、折点及趋势的特殊意义;注意明确各点表示的意义.

练习册系列答案
相关题目
下列说法正确的是( )
| A、在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析出产生沉淀 |
| B、司目戊鼎、定远舰甲板、有机玻璃等原料属于合金 |
| C、聚酯纤维、碳纤维、光导纤维都属于有机高分子材料 |
| D、工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁、均需要石灰石为原料 |
纳米钴(Co)常用于CO加氢反应的催化剂,500K时有催化反应:CO(g)+3H2(g)═CH4(g)+H2O(g)△H<0.下列有关说法正确的是( )
| A、纳米技术的应用,提高了催化剂的催化性能 |
| B、缩小容器体积,平衡向正反应方向移动,CO的浓度减小 |
| C、温度越低,越有利于CO催化加氢 |
| D、从平衡体系中分离出H2O(g)能加快正反应速率 |
如图是部分短周期主族元素原子半径与原子序数的关系图.下列说法正确的是( )
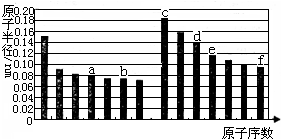

| A、a的单质在高温条件下能置换出e的单质,说明非金属性a<e |
| B、b、d两种元素的离子半径相比,前者较大 |
| C、由b、e两种元素组成的化合物能溶解于强碱溶液,但不能与酸溶液反应 |
| D、由c、d分别与f组成的化合物中的化学键类型相同 |
用NA代表阿伏加德罗常数,下列说法正确的是( )
| A、14gC2H4和C4H8的混合气体中所含的共价键数为3NA |
| B、标准状况下,11.2L SO3所含的分子数为0.5NA |
| C、24g3H218O含有的中子数为12NA |
| D、0.1mol O22-所含的电子数为1.6NA |
下列物质中其电子式可用 表示的是( )
表示的是( )
 表示的是( )
表示的是( )| A、HClO | B、NaHS |
| C、KOH | D、KClO |
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)?4NO2(g)+O2(g)△H>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见下表下列说法中不正确的是( )
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A、T1温度下,500s时O2的浓度为0.74mol?L-1 | ||
B、平衡后其它条件不变,将容器的体积压缩到原来的
| ||
| C、T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | ||
| D、T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为0.5 |
 下表为元素周期表的一部分,列出10种元素在周期表中的位置. 用化学符号回答下列问题:
下表为元素周期表的一部分,列出10种元素在周期表中的位置. 用化学符号回答下列问题: