题目内容
下列关于离子的叙述正确的是( )
| A、在c(H+)=1×10-13mol?L-1的溶液中:Na+、Fe3+、Cl-、SO42-能大量共存 |
| B、铜溶于FeCl3溶液中:Cu+Fe3+=Fe2++Cu2+ |
| C、NaHCO3溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D、向溶液中加入BaCl2溶液后再加盐酸,有白色沉淀,说明该溶液中一定含有SO42- |
考点:离子共存问题,离子方程式的书写,离子浓度大小的比较,硫酸根离子的检验
专题:
分析:A.该溶液为碱性溶液,铁离子与氢氧根离子反应生成氢氧化铁沉淀;
B.离子方程式两边正电荷不相等,不满足电荷守恒;
C.根据碳酸氢钠溶液中的物料守恒判断;
D.原溶液中可能存在银离子,不一定存在硫酸根离子.
B.离子方程式两边正电荷不相等,不满足电荷守恒;
C.根据碳酸氢钠溶液中的物料守恒判断;
D.原溶液中可能存在银离子,不一定存在硫酸根离子.
解答:
解:A.在c(H+)=1×10-13mol?L-1的溶液中存在大量氢氧根离子,Fe3+、OH-之间发生反应生成氢氧化铁沉淀,在溶液中不能大量共存,故A错误;
B.铜溶于FeCl3溶液中生成亚铁离子和铜离子,正确的离子方程式为:Cu+2Fe3+=2Fe2++Cu2+,故B错误;
C.NaHCO3溶液中,根据物料守恒可得:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),故C正确;
D.向溶液中加入BaCl2溶液后再加盐酸,有白色沉淀,该白色沉淀可能为氯化银,原溶液中可能存在银离子,不一定含有SO42-,故D错误;
故选C.
B.铜溶于FeCl3溶液中生成亚铁离子和铜离子,正确的离子方程式为:Cu+2Fe3+=2Fe2++Cu2+,故B错误;
C.NaHCO3溶液中,根据物料守恒可得:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),故C正确;
D.向溶液中加入BaCl2溶液后再加盐酸,有白色沉淀,该白色沉淀可能为氯化银,原溶液中可能存在银离子,不一定含有SO42-,故D错误;
故选C.
点评:本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图,下列对该实验的描叙错误的是( )
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图,下列对该实验的描叙错误的是( )| A、为使受热均匀,可改用水浴加热 |
| B、长玻璃管冷凝回流作用 |
| C、提纯乙酸丁酯需要经过水、饱和碳酸钠溶液洗涤 |
| D、加入过量乙酸可以提高1-丁醇的转化率 |
常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通入少量CO2气体生成HX和NaHCO3;往NaY溶液中通入少量CO2生成HY和Na2CO3.下列有关叙述正确的是( )
| A、酸性由强至弱:HX>HY>H2CO3 |
| B、结合H+的能力:Y->CO32->X->HCO3- |
| C、溶液碱性:NaX>Na2CO3>NaY>NaHCO3 |
| D、NaX溶液中通入足量CO2后的离子浓度:c(Na+)>c(HCO3-)>c(X-)>c(OH-)>c(H+) |
下列说法中正确的是( )
①所有铵盐受热均可以分解,产物均有NH3
②所有铵盐都易溶于水,不是所有铵盐中的氮均呈-3价
③NH4Cl溶液中加入NaOH浓溶液共热时反应的离子方程式为NH4+OH-
NH3↑+H2O
④NH4Cl和NaCl的固体混合物可用升华法分离.
①所有铵盐受热均可以分解,产物均有NH3
②所有铵盐都易溶于水,不是所有铵盐中的氮均呈-3价
③NH4Cl溶液中加入NaOH浓溶液共热时反应的离子方程式为NH4+OH-
| ||
④NH4Cl和NaCl的固体混合物可用升华法分离.
| A、①② | B、②③ | C、③④ | D、①④ |
纳米钴(Co)常用于CO加氢反应的催化剂,500K时有催化反应:CO(g)+3H2(g)═CH4(g)+H2O(g)△H<0.下列有关说法正确的是( )
| A、纳米技术的应用,提高了催化剂的催化性能 |
| B、缩小容器体积,平衡向正反应方向移动,CO的浓度减小 |
| C、温度越低,越有利于CO催化加氢 |
| D、从平衡体系中分离出H2O(g)能加快正反应速率 |
已知25℃时,Mg( OH)2的溶度积常数Ksp=5.6×l0-12.取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得溶液的pH=13.0,则下列说法不正确的是( )
| A、所得溶液中的c (H+)=10-13 mol.L-1 |
| B、所得溶液中由水电离产生的c(OH -)=10-13mol.L-1 |
| C、所得溶液中的c (Mg2+)=5.6×l0-10 mol.L-1 |
| D、所加烧碱溶液的pH=13.0 |
如图是部分短周期主族元素原子半径与原子序数的关系图.下列说法正确的是( )
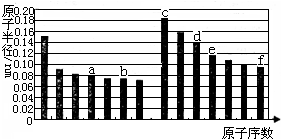

| A、a的单质在高温条件下能置换出e的单质,说明非金属性a<e |
| B、b、d两种元素的离子半径相比,前者较大 |
| C、由b、e两种元素组成的化合物能溶解于强碱溶液,但不能与酸溶液反应 |
| D、由c、d分别与f组成的化合物中的化学键类型相同 |
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示: