题目内容
利用如图所示联合装置制备金属钛,下列叙述正确的是( )


| A、甲装置中通入O2的电极反应式为:O2+4e-═2O2- |
| B、若不考虑能量的损失,制备24.0g金属钛,需要消耗氢气22.4 L |
| C、甲装置工作过程中pH减小 |
| D、乙装置中的石墨电极反应式为:C+2O2--4e-═CO2↑ |
考点:原电池和电解池的工作原理
专题:
分析:根据图知,甲为燃料电池,氢气为负极,被氧化,氧气为正极,发生还原反应,乙为电解装置,阳极上电极反应式为C+2O2--4e-═CO2↑,阴极上电极反应式为:2Ca2++4e-═2Ca,钙还原二氧化钛反应方程式为:2Ca+TiO2=Ti+2CaO,以此解答该题.
解答:
解:A.甲装置通入O2的电极为正极,反应式为O2+4H++4e-═2H2O,故A错误;
B.n(Ti)=
=0.5mol,则消耗1molCa,转移2mol电子,由电极方程式H2-2e-═2H+可知,需要1molH2,则在标况下才为22.4 L,故B错误;
C.甲装置总反应为O2+2H2═2H2O,生成水导致磷酸浓度降低,则pH增大,故C错误;
D.乙装置石墨电极为阳极,电极反应式为C+2O2--4e-═CO2↑,故D正确.
故选D.
B.n(Ti)=
| 24.0g |
| 48.0g/mol |
C.甲装置总反应为O2+2H2═2H2O,生成水导致磷酸浓度降低,则pH增大,故C错误;
D.乙装置石墨电极为阳极,电极反应式为C+2O2--4e-═CO2↑,故D正确.
故选D.
点评:本题综合考查电解池和原电池知识,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握电极方程式的书写,为解答该类题目的关键,难度中等.

练习册系列答案
相关题目
有甲( )、乙(
)、乙( )两种有机物,下列说法中不正确的是( )
)两种有机物,下列说法中不正确的是( )
 )、乙(
)、乙( )两种有机物,下列说法中不正确的是( )
)两种有机物,下列说法中不正确的是( )| A、可用新制的氢氧化铜悬浊液区分这两种有机物 |
| B、甲、乙互为同分异构体 |
| C、1 mol甲与H2在一定条件下反应,最多消耗3 mol H2 |
| D、等物质的量的甲、乙分别与NaOH溶液反应消耗NaOH的量相同 |
常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通入少量CO2气体生成HX和NaHCO3;往NaY溶液中通入少量CO2生成HY和Na2CO3.下列有关叙述正确的是( )
| A、酸性由强至弱:HX>HY>H2CO3 |
| B、结合H+的能力:Y->CO32->X->HCO3- |
| C、溶液碱性:NaX>Na2CO3>NaY>NaHCO3 |
| D、NaX溶液中通入足量CO2后的离子浓度:c(Na+)>c(HCO3-)>c(X-)>c(OH-)>c(H+) |
纳米钴(Co)常用于CO加氢反应的催化剂,500K时有催化反应:CO(g)+3H2(g)═CH4(g)+H2O(g)△H<0.下列有关说法正确的是( )
| A、纳米技术的应用,提高了催化剂的催化性能 |
| B、缩小容器体积,平衡向正反应方向移动,CO的浓度减小 |
| C、温度越低,越有利于CO催化加氢 |
| D、从平衡体系中分离出H2O(g)能加快正反应速率 |
已知25℃时,Mg( OH)2的溶度积常数Ksp=5.6×l0-12.取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得溶液的pH=13.0,则下列说法不正确的是( )
| A、所得溶液中的c (H+)=10-13 mol.L-1 |
| B、所得溶液中由水电离产生的c(OH -)=10-13mol.L-1 |
| C、所得溶液中的c (Mg2+)=5.6×l0-10 mol.L-1 |
| D、所加烧碱溶液的pH=13.0 |
如图是部分短周期主族元素原子半径与原子序数的关系图.下列说法正确的是( )
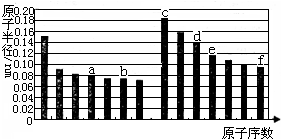

| A、a的单质在高温条件下能置换出e的单质,说明非金属性a<e |
| B、b、d两种元素的离子半径相比,前者较大 |
| C、由b、e两种元素组成的化合物能溶解于强碱溶液,但不能与酸溶液反应 |
| D、由c、d分别与f组成的化合物中的化学键类型相同 |
下列物质中其电子式可用 表示的是( )
表示的是( )
 表示的是( )
表示的是( )| A、HClO | B、NaHS |
| C、KOH | D、KClO |
