题目内容
15.丁烷的催化裂解可按下列两种方式进行:C4H10-→C2H6+C2H4;C4H10-→CH4+C3H6;某化学兴趣小组的同学为探究丁烷裂解气中CH4和C2H6的比例关系,设计如图所示实验:
注:CuO能将烃氧化成CO2和H2O;Al2O3是丁烷裂解的催化剂,G后面装置已省略.如图连接好装置后(部分夹持装置已略去),需进行的实验操作有:
①给D、G装置加热;②检查整套装置的气密性;③排尽装置中的空气.
(1)这三步操作的先后顺序依次是②③①.
(2)B装置所起的作用是通过观察气泡,调节K,控制气体流速.
(3)假设丁烷完全裂解,流经各装置中的气体能完全反应.当(E和F)装置的总质量比反应前增加了1.82g,G装置中固体质量减少了4.16g,则丁烷的裂解产物中n(CH4):n(C2H6)=3:2.
(4)若对E装置中的混合物再按以下流程实验:

①分离操作Ⅰ、Ⅱ的名称是Ⅰ分液、Ⅱ蒸馏;
②Na2SO3溶液的作用是(用离子方程式表示)SO32-+Br2+H2O=SO42-+2Br-+2H+.Y生成C3H4的反应类型是消去反应.
分析 (1)根据实验装置及操作要求可知,应先检验气密性,赶出内部气体,再加热;
(2)B装置中装有水,通过观察气泡,可以控制气体的流速;
(3)E、F吸收的是烯烃,G减少的质量是氧化铜中的氧元素质量,丁烷的裂解中,生成乙烯的物质的量和乙烷的物质的量相等,甲烷和丙烯的物质的量相等,再结合原子守恒计算甲烷和乙烷的物质的量之比;
(4)混合物中含有单质溴、水、1,2-二溴乙烷、1,2-二溴丙烷,加入亚硫酸钠,亚硫酸钠被溴氧化生成硫酸钠,同时生成NaBr,从而除去单质溴,1,2-二溴乙烷、1,2-二溴丙烷都不溶于水,溶液分层,采用分液的方法分离出混合物和有机层,互溶的1,2-二溴乙烷、1,2-二溴丙烷采用蒸馏的方法分离,根据Y在氢氧化钠醇溶液中发生消去反应生成C3H4,可知Y为1,2-二溴丙烷,所以X为1,2-二溴乙烷,
①互不相溶的液体采用分液的方法分离,互溶的液体采用蒸馏的方法分离;
②亚硫酸钠具有还原性,能和溴反应除去溴;卤代烃在氢氧化钠醇溶液中发生消去反应.
解答 解:(1)根据实验装置及操作要求可知,应先检查整套装置的气密性,排出装置中的空气,再给D、G装置加热,所以正确的操作顺序为②③①,故答案为:②③①;
(2)B装置中盛有水,可以通过观察B中产生的气泡快慢来控制气体的流速,
故答案为:通过观察气泡,调节K,控制气体流速;
(3)丁烷的裂解中生成的乙烯和乙烷的物质的量相等,生成的甲烷和丙烯的物质的量相等,E、F吸收的是烯烃,设C2H4的物质的量为x,C3H6的物质的量为y,乙烷和甲烷的物质的量分别是x、y,则:28x+42y=1.82g,
G减少的质量是氧化铜中的氧元素质量,乙烷和甲烷和氧化铜反应需要的氧原子的物质的量为:2(2x+y)+$\frac{6x+4y}{2}$=$\frac{4.16}{16}$,
解得:x=0.02mol、y=0.03mol,
则n(CH4):n(C2H6)=3:2,
故答案为:3:2;
(4)混合物中含有有机物和溴,向混合物中加入亚硫酸钠溶液后,溶液分层,采用分液的方法分离出混合物和有机层,互溶的液体采用蒸馏的方法分离,分离出甲和乙,
①互不相溶的液体采用分液的方法分离,互溶的液体采用蒸馏的方法分离,所以操作I、操作II分别是分液、蒸馏,故答案为:分液;蒸馏;
②亚硫酸钠具有还原性,能和强氧化性物质溴反应而除去溴,反应的离子方程式为:SO32-+Br2+H2O=SO42-+2Br-+2H+,Y在氢氧化钠醇溶液中发生消去反应生成C3H4,所以反应类型为消去反应,
故答案为:SO32-+Br2+H2O=SO42-+2Br-+2H+;消去反应.
点评 本题考查实验操作、实验计算、物质分离和提纯的方法等知识点,题目难度中等,难点是计算甲烷和甲烷的物质的量之比,明确质量增加的量和质量减少的量分别是什么物质是解本题的关键.


| A. | 分子中所有的碳原子均可能在同一平面内 | |
| B. | 绿原酸可以与FeCl3溶液发生显色反应 | |
| C. | 1 mol绿原酸与足量溴水反应,最多消耗2.5mol Br2 | |
| D. | 绿原酸不能发生消去反应 |
| A. | 陶瓷的主要成分属于硅酸盐,硅酸盐与酸、碱都不反应 | |
| B. | 青铜铸造的器皿在空气中易发生析氢腐蚀,铜为原电池负极反应物 | |
| C. | 以树皮和麻绳为原料所造的纸张其主要成分是纤维素,纤维素与淀粉互为同分异构体 | |
| D. | 黑火药反应:2KNO3+S+3C═K2S+N2+3CO2 的还原剂只有C |
| A. | △H1>△H2 | B. | △H1<△H2 | C. | △H1=△H2 | D. | 无法确定 |
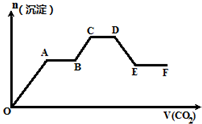 将CO2气体缓缓地通入到含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示.下列关于整个反应进程中的各种描述不正确的是( )
将CO2气体缓缓地通入到含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示.下列关于整个反应进程中的各种描述不正确的是( )| A. | O~A段反应的离子方程式是Ba2++CO32-═BaCO3↓ | |
| B. | A~B段反应的离子方程式是2OH-+CO2═CO${\;}_{3}^{2-}$+H2O | |
| C. | A~B段与C~D段所发生的反应相同 | |
| D. | D~E段沉淀的减少是由于碳酸钡固体与CO2的水溶液反应所致 |
| A. | Cl2与水反应:Cl2+H2O═2H++ClO-+Cl- | |
| B. | CuSO4溶液中加入Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 将鸡蛋壳在醋酸中溶解有气泡产生:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 铁与盐酸反应:Fe+2H+═Fe2++H2↑ |
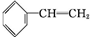 +Br2
+Br2
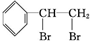 ,
, .
. .
. 如图所示,乙酸跟乙醇在浓硫酸存在并加热的条件下发生酯化反应(反应A),其逆反应是水解反应(反应B).反应可能经历了生成中间体(Ⅰ)这一步.
如图所示,乙酸跟乙醇在浓硫酸存在并加热的条件下发生酯化反应(反应A),其逆反应是水解反应(反应B).反应可能经历了生成中间体(Ⅰ)这一步. )或羟基基的氧原子用18O标记,则生成物水中前者没有、后者有(填“有”或“没有”)18O,作出上述判断的理由是羧酸分子中的羟基与醇分子中羟基的氢原子结合成水.
)或羟基基的氧原子用18O标记,则生成物水中前者没有、后者有(填“有”或“没有”)18O,作出上述判断的理由是羧酸分子中的羟基与醇分子中羟基的氢原子结合成水.