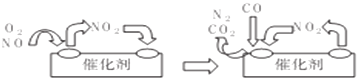
题目内容
4.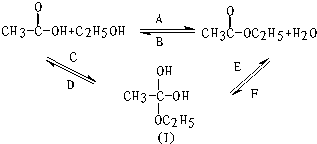 如图所示,乙酸跟乙醇在浓硫酸存在并加热的条件下发生酯化反应(反应A),其逆反应是水解反应(反应B).反应可能经历了生成中间体(Ⅰ)这一步.
如图所示,乙酸跟乙醇在浓硫酸存在并加热的条件下发生酯化反应(反应A),其逆反应是水解反应(反应B).反应可能经历了生成中间体(Ⅰ)这一步.(1)A~F六个反应中,属于取代反应的是AB(填编号,下同).属于加成反应的是CF.
(2)如果将原料C2H50H中的氧原子用18O标记,则生成物乙酸乙酯中有(填“有”或“没有”)18O,如果将原料CH3COOH中羰基(
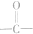 )或羟基基的氧原子用18O标记,则生成物水中前者没有、后者有(填“有”或“没有”)18O,作出上述判断的理由是羧酸分子中的羟基与醇分子中羟基的氢原子结合成水.
)或羟基基的氧原子用18O标记,则生成物水中前者没有、后者有(填“有”或“没有”)18O,作出上述判断的理由是羧酸分子中的羟基与醇分子中羟基的氢原子结合成水.
分析 (1)题中涉及反应有酯化反应以及酯的水解,二者都为取代反应,还涉及到羧基的加成以及羟基的消去;
(2)羧酸跟醇的反应过程一般是:羧酸分子中的羟基与醇分子中羟基的氢原子结合成水,其余部分互相结合成酯,即酸去羟基醇去羟基氢.
解答 解:(1)从图示可知A反应烷氧基取代了羟基,属于取代反应,
B反应为水中羟基取代了烷氧基,属于取代反应;
C反应双键变成了单键属于加成反应,
D反应形成了双键属于消去反应,
E反应形成了双键属于消去反应,
F反应双键变成了单键属于加成反应,
故答案为:AB;CF;
(2)羧酸跟醇的反应过程一般是:羧酸分子中的羟基与醇分子中羟基的氢原子结合成水,将原料C2H50H中的氧原子用18O标记,则生成物乙酸乙酯中有18O,
如果将原料CH3COOH中羰基(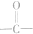 )的氧原子用18O标记,则生成物乙酸乙酯中有18O,而水中没有18O;
)的氧原子用18O标记,则生成物乙酸乙酯中有18O,而水中没有18O;
如果将原料CH3COOH中羟基的氧原子用18O标记,C-O键断裂,则水中有18O,
故答案为:有;前者没有、后者有;羧酸分子中的羟基与醇分子中羟基的氢原子结合成水.
点评 考查酯化反应的原理与特点,为高频考点,注意羧酸跟醇的酯化反应是可逆的,羧酸跟醇的反应过程一般是:羧酸分子中的羟基与醇分子中羟基的氢原子结合成水,其余部分互相结合成酯,难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
14.下列物质中含有亲水基团但不溶于水的是( )
| A. | CH3CH2Br | B. | CH3(CH2)11CH2OH | ||
| C. | C17H35COONa | D. |  |
19.正丁烷的二氯取代产物有几种( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
9.下列实验操作或事故处理中,正确的做法是( )
| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌 | |
| C. | 不慎将浓硝酸沾到皮肤上,立即用NaOH溶液冲洗 | |
| D. | 检测某溶液是否含有SO${\;}_{4}^{2-}$时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
16.pH=0的某溶液中还可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下一系列实验:
下列有关判断正确的是( )

下列有关判断正确的是( )
| A. | 试液中一定有Fe2+、SO42-、H+、NH4+、Al3+ | |
| B. | 试液中一定没有Ba2+、CO32-、NO3- | |
| C. | 步骤③中反应的离子方程式为:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 气体A、B之间肯定不能发生反应 |
2. 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.
(2)B、C、D三种元素的第一电离能由小到大的顺序为C<O<N.
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(4)下列叙述正确的是ad(填序号).
a. M是极性分子,N是非极性分子
b. M和BD2分子中的中心原子均采用sp2杂化
c. N分子中含有6个σ键和1个π键
d. BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:①E的一种氧化物Q,其晶胞结构如图所示
①Q(s)+2Cl2(g)=ECl4(l)+D2(g)△H=+140kJ/mol
②2B(s)+D2(g)=2BD(g)△H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECI4和BD气体的热化学方程式:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol
(6)在0.5L的密闭容器中,一定量的C2和A2进行如下化学反应:C2(g)+3A2(g)=2CA3(g)△H<0,其化学平衡常数K与温度t的关系如表.请回答下列问题.
①试比较K1,K2的大小,K1>K2(填写“>”、“=”或“<”).
②在400℃时,当测得CA3和C2、A2的物质的量分别为3mol和1mol、2mol时,则该反应的 V(C2)正>(C2)逆(填写“>”、“=”或“<”).
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为
 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.(2)B、C、D三种元素的第一电离能由小到大的顺序为C<O<N.
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(4)下列叙述正确的是ad(填序号).
a. M是极性分子,N是非极性分子
b. M和BD2分子中的中心原子均采用sp2杂化
c. N分子中含有6个σ键和1个π键
d. BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:①E的一种氧化物Q,其晶胞结构如图所示
①Q(s)+2Cl2(g)=ECl4(l)+D2(g)△H=+140kJ/mol
②2B(s)+D2(g)=2BD(g)△H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECI4和BD气体的热化学方程式:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol
(6)在0.5L的密闭容器中,一定量的C2和A2进行如下化学反应:C2(g)+3A2(g)=2CA3(g)△H<0,其化学平衡常数K与温度t的关系如表.请回答下列问题.
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②在400℃时,当测得CA3和C2、A2的物质的量分别为3mol和1mol、2mol时,则该反应的 V(C2)正>(C2)逆(填写“>”、“=”或“<”).
3.下列说法中错误的是( )
| A. | 将足量二氧化硫通入酸性高锰酸钾溶液中,溶液褪色,说明二氧化硫具有还原性 | |
| B. | 二氧化硫的水溶液中滴加氯化钡无现象,再加入0.5 mL 3%的过氧化氢后产生沉淀 | |
| C. | 二氧化硫能漂白某些物质,说明它具有氧化性 | |
| D. | 二氧化硫漂白过的草帽过一段时间后变黄 |