题目内容
6.将点燃的铁丝伸入到收满氯气的集气瓶中,观察到铁丝继续燃烧,生成大量的棕黄色的烟(填现象),燃烧结束后往集气瓶中加入适量的水,有棕黄色溶液生成,这时候往溶液中滴加硫氰化钾溶液 可观察到溶液变成血红色,再往溶液中加入过量铁粉,振荡血红色消失,再加足量的氯水,又出现血红色.按照顺序写出相关的化学反应方程式或者离子反应方程式(4个):2Fe+3Cl2=2FeCl3、Fe3++3SCN-=Fe(SCN)3、2Fe3++Fe=3Fe2+、2Fe2++Cl2=2Fe3++2Cl-.分析 铁为变价金属,氯气具有强氧化性,铁和氯气反应生成氯化铁呈棕黄色固体,氯化铁溶解后得到氯化铁溶液为棕黄色溶液,加入硫氰化钾溶液溶液和铁离子结合生成血红色溶液,溶液中加入铁还原铁离子,化学平衡逆向进行红色消失,通入足量氯气,氯气氧化亚铁离子生成铁离子溶液又生成硫氰酸铁红色溶液;
解答 解:铁为变价金属,氯气具有强氧化性,铁和氯气反应生成氯化铁呈棕黄色固体,2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,氯化铁溶解后得到氯化铁溶液为棕黄色溶液,加入硫氰化钾溶液溶液和铁离子结合生成血红色溶液,反应的离子方程式为:Fe3++3SCN-=Fe(SCN)3,溶液中加入铁还原铁离子,反应的离子方程式为:2Fe3++Fe=3Fe2+,化学平衡逆向进行红色消失,通入足量氯气,氯气氧化亚铁离子生成铁离子溶液又生成硫氰酸铁红色溶液,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:棕黄色的烟;棕黄色;硫氰化钾溶液;2Fe+3Cl2=2FeCl3;Fe3++3SCN-=Fe(SCN)3;2Fe3++Fe=3Fe2+;2Fe2++Cl2=2Fe3++2Cl-.
点评 本题考查了铁及其化合物性质、离子检验、氧化还原反应产物判断和离子方程式书写,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
16.构造原理揭示的电子排布能级顺序,实质是各能级能量高低.若以E(nl)表示某能级的能量,以下各式中正确的是( )
| A. | E(5s)>E(4f)>E(4s)>E(3d) | B. | E(4f)>E(3d)>E(4s)>E(3p) | C. | E(5d)>E(4d)>E(3d)>E(2d) | D. | E(5s)>E(4s)>E(4f)>E(3d) |
14.下列物质中含有亲水基团但不溶于水的是( )
| A. | CH3CH2Br | B. | CH3(CH2)11CH2OH | ||
| C. | C17H35COONa | D. |  |
11.下列符合中,表示2个氢分子的是( )
| A. | H2 | B. | 2H | C. | 2H2 | D. | 2H+ |
18.高锰酸钾是中学化学常用的强氧化剂,实验室中可通过以下反应制得:
MnO2熔融氧化:3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
已知K2MnO4溶液显绿色,KMnO4溶液显紫红色.实验流程如下:
请回答:
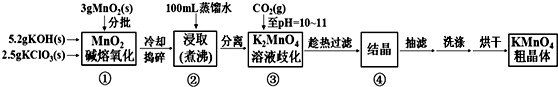
(1)步骤①应在D中熔化,并用铁棒用力搅拌,以防结块.
A.烧杯 B.蒸发皿 C.瓷坩埚 D.铁坩埚
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是B.
A.二氧化硫 B.稀醋酸 C.稀盐酸 D.稀硫酸
②当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低.
(3)烘干时,温度控制在80℃为宜,理由是如果温度过低,烘干时间过长,如果温度过高,高锰酸钾受热分解.
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极.请写出阳极的电极反应式MnO42--e-═MnO4-,与原方法相比,电解法的优势为K2MnO4中的锰元素可以完全转化到KMnO4中,提高利用率.
(5)通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数).
①量取KMnO4溶液应选用酸式(填“酸式”或“碱式”)滴定管;若量取KMnO4溶液的滴定管用蒸馏水洗净后未润洗,则最终测定结果将偏小(填“偏大”、“偏小”或“不变”).
②滴定过程中反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.(已知:常温下0.01mol/L的H2C2O4溶液的pH为2.1).
MnO2熔融氧化:3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
| 20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
请回答:

(1)步骤①应在D中熔化,并用铁棒用力搅拌,以防结块.
A.烧杯 B.蒸发皿 C.瓷坩埚 D.铁坩埚
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是B.
A.二氧化硫 B.稀醋酸 C.稀盐酸 D.稀硫酸
②当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低.
(3)烘干时,温度控制在80℃为宜,理由是如果温度过低,烘干时间过长,如果温度过高,高锰酸钾受热分解.
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极.请写出阳极的电极反应式MnO42--e-═MnO4-,与原方法相比,电解法的优势为K2MnO4中的锰元素可以完全转化到KMnO4中,提高利用率.
(5)通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数).
①量取KMnO4溶液应选用酸式(填“酸式”或“碱式”)滴定管;若量取KMnO4溶液的滴定管用蒸馏水洗净后未润洗,则最终测定结果将偏小(填“偏大”、“偏小”或“不变”).
②滴定过程中反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.(已知:常温下0.01mol/L的H2C2O4溶液的pH为2.1).
16.pH=0的某溶液中还可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下一系列实验:
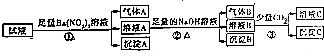
下列有关判断正确的是( )

下列有关判断正确的是( )
| A. | 试液中一定有Fe2+、SO42-、H+、NH4+、Al3+ | |
| B. | 试液中一定没有Ba2+、CO32-、NO3- | |
| C. | 步骤③中反应的离子方程式为:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 气体A、B之间肯定不能发生反应 |
 (1)25℃时,pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为6.生成的正盐中存在着一定水解的离子,该离子水解的离子方程式为An-+H2O?HA(n-1)-+OH-.
(1)25℃时,pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为6.生成的正盐中存在着一定水解的离子,该离子水解的离子方程式为An-+H2O?HA(n-1)-+OH-.