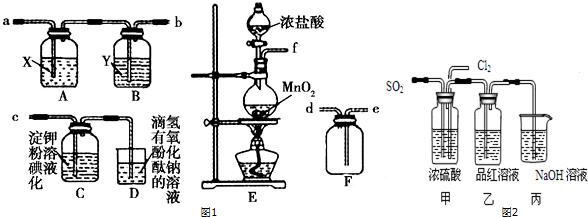
题目内容
3.绿原酸的结构简式如图,关于绿原酸判断正确的是( )
| A. | 分子中所有的碳原子均可能在同一平面内 | |
| B. | 绿原酸可以与FeCl3溶液发生显色反应 | |
| C. | 1 mol绿原酸与足量溴水反应,最多消耗2.5mol Br2 | |
| D. | 绿原酸不能发生消去反应 |
分析 该有机物中含苯环、酚-OH、C=C、-COOC-、-COOH、-OH,结合酚、醇、羧酸、酯、烯烃的性质来解答.
解答 解:A.环己烷结构中的C原子的共价键达到饱和,均为四面体构型,则分子中所有的碳原子不可能在同一平面内,故A错误;
B.绿原酸含分酚-OH,可以与FeCl3溶液发生显色反应,故B正确;
C.酚-OH的邻对位与溴水发生取代,C=C与溴水发生加成,则1 mol绿原酸与足量溴水反应,最多消耗4molBr2,故C错误;
D.环己烷结构中含-OH,且与-OH相连C的邻位C上有H,可发生消去反应,故D错误.
故选B.
点评 本题考查有机物的结构与性质,为高考常见题型,注意把握常见的官能团及性质的关系,熟悉酚、醇、羧酸、酯、烯烃的性质是解答的关键,题目难度不大.

练习册系列答案
相关题目
14.下列物质中含有亲水基团但不溶于水的是( )
| A. | CH3CH2Br | B. | CH3(CH2)11CH2OH | ||
| C. | C17H35COONa | D. |  |
11.下列符合中,表示2个氢分子的是( )
| A. | H2 | B. | 2H | C. | 2H2 | D. | 2H+ |
18.高锰酸钾是中学化学常用的强氧化剂,实验室中可通过以下反应制得:
MnO2熔融氧化:3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
已知K2MnO4溶液显绿色,KMnO4溶液显紫红色.实验流程如下:
请回答:
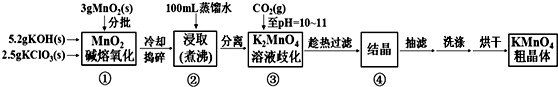
(1)步骤①应在D中熔化,并用铁棒用力搅拌,以防结块.
A.烧杯 B.蒸发皿 C.瓷坩埚 D.铁坩埚
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是B.
A.二氧化硫 B.稀醋酸 C.稀盐酸 D.稀硫酸
②当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低.
(3)烘干时,温度控制在80℃为宜,理由是如果温度过低,烘干时间过长,如果温度过高,高锰酸钾受热分解.
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极.请写出阳极的电极反应式MnO42--e-═MnO4-,与原方法相比,电解法的优势为K2MnO4中的锰元素可以完全转化到KMnO4中,提高利用率.
(5)通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数).
①量取KMnO4溶液应选用酸式(填“酸式”或“碱式”)滴定管;若量取KMnO4溶液的滴定管用蒸馏水洗净后未润洗,则最终测定结果将偏小(填“偏大”、“偏小”或“不变”).
②滴定过程中反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.(已知:常温下0.01mol/L的H2C2O4溶液的pH为2.1).
MnO2熔融氧化:3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
| 20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
请回答:

(1)步骤①应在D中熔化,并用铁棒用力搅拌,以防结块.
A.烧杯 B.蒸发皿 C.瓷坩埚 D.铁坩埚
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是B.
A.二氧化硫 B.稀醋酸 C.稀盐酸 D.稀硫酸
②当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低.
(3)烘干时,温度控制在80℃为宜,理由是如果温度过低,烘干时间过长,如果温度过高,高锰酸钾受热分解.
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极.请写出阳极的电极反应式MnO42--e-═MnO4-,与原方法相比,电解法的优势为K2MnO4中的锰元素可以完全转化到KMnO4中,提高利用率.
(5)通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数).
①量取KMnO4溶液应选用酸式(填“酸式”或“碱式”)滴定管;若量取KMnO4溶液的滴定管用蒸馏水洗净后未润洗,则最终测定结果将偏小(填“偏大”、“偏小”或“不变”).
②滴定过程中反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.(已知:常温下0.01mol/L的H2C2O4溶液的pH为2.1).
2. 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.
(2)B、C、D三种元素的第一电离能由小到大的顺序为C<O<N.
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(4)下列叙述正确的是ad(填序号).
a. M是极性分子,N是非极性分子
b. M和BD2分子中的中心原子均采用sp2杂化
c. N分子中含有6个σ键和1个π键
d. BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:①E的一种氧化物Q,其晶胞结构如图所示
①Q(s)+2Cl2(g)=ECl4(l)+D2(g)△H=+140kJ/mol
②2B(s)+D2(g)=2BD(g)△H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECI4和BD气体的热化学方程式:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol
(6)在0.5L的密闭容器中,一定量的C2和A2进行如下化学反应:C2(g)+3A2(g)=2CA3(g)△H<0,其化学平衡常数K与温度t的关系如表.请回答下列问题.
①试比较K1,K2的大小,K1>K2(填写“>”、“=”或“<”).
②在400℃时,当测得CA3和C2、A2的物质的量分别为3mol和1mol、2mol时,则该反应的 V(C2)正>(C2)逆(填写“>”、“=”或“<”).
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为
 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.(2)B、C、D三种元素的第一电离能由小到大的顺序为C<O<N.
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(4)下列叙述正确的是ad(填序号).
a. M是极性分子,N是非极性分子
b. M和BD2分子中的中心原子均采用sp2杂化
c. N分子中含有6个σ键和1个π键
d. BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:①E的一种氧化物Q,其晶胞结构如图所示
①Q(s)+2Cl2(g)=ECl4(l)+D2(g)△H=+140kJ/mol
②2B(s)+D2(g)=2BD(g)△H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECI4和BD气体的热化学方程式:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol
(6)在0.5L的密闭容器中,一定量的C2和A2进行如下化学反应:C2(g)+3A2(g)=2CA3(g)△H<0,其化学平衡常数K与温度t的关系如表.请回答下列问题.
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②在400℃时,当测得CA3和C2、A2的物质的量分别为3mol和1mol、2mol时,则该反应的 V(C2)正>(C2)逆(填写“>”、“=”或“<”).