题目内容
5.从某正盐A的浓溶液出发有如图所示的一系列变化.请回答: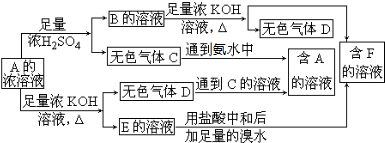
(1)写出A、B、C、D、E、F的化学式:
A(NH4)2SO3或NH4HSO3,CSO2,DNH3,
EK2SO3,FK2SO4.
(2)写出E溶液中通入足量Cl2的离子方程式SO32-+Cl2+H2O=SO42-+2Cl-+2H+.
分析 A可跟酸反应,又可与碱反应,生成两种气体,且两种气体能反应,由C+氨水→A,D+C的溶液→A,知D为NH3,则A为铵盐,由A可跟酸反应,又可与碱反应,A为弱酸弱碱盐,由A的溶液+浓H2SO4→B+C,知B是NH4HSO4或(NH4)2SO4,推知F为K2SO4,由A的溶液+KOH→E+D,知E为K2SO3,C为SO2,A为(NH4)2SO3或NH4HSO3,以此解答该题.
解答 解:A可跟酸反应,又可与碱反应,生成两种气体,且两种气体能反应,由C+氨水→A,D+C的溶液→A,知D为NH3,则A为铵盐,由A可跟酸反应,又可与碱反应,A为弱酸弱碱盐,由A的溶液+浓H2SO4→B+C,知B是NH4HSO4或(NH4)2SO4,推知F为K2SO4,由A的溶液+KOH→E+D,知E为K2SO3,C为SO2,A为(NH4)2SO3或NH4HSO3,
(1)由以上分析可知A为(NH4)2SO3或NH4HSO3,C为SO2,D为NH3,E为K2SO3,F为K2SO4,故答案为:(NH4)2SO3或NH4HSO3;SO2;NH3;K2SO3;K2SO4;
(2)E为K2SO3,SO32-具有还原性,与具有氧化性的Cl2发生氧化还原反应生成SO42-和Cl-,反应的化学方程式为K2SO3+Cl2+H2O=K2SO4+2HCl,反应的离子方程式为:SO32-+Cl2+H2O=SO42-+2Cl-+2H+,
故答案为:SO32-+Cl2+H2O=SO42-+2Cl-+2H+.
点评 本题考查了无机物的推断,为高频考点,侧重于学生的分析能力的考查,解答无机框图题,须找到解题突破口,本题注意A可跟酸反应,又可与碱反应,为解答该题的关键,题目难度中等.

练习册系列答案
相关题目
15.13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtWuthrich 等人为此获得2002年诺贝尔化学奖.下面有关13C、15N的叙述中正确的是( )
| A. | 13C与15N有相同的中子数 | |
| B. | 13C一种同位素14C具有放射性,14C不可用于考古断代,推算出文物的年代 | |
| C. | 一个15N的质量约为2.5×10-25 kg | |
| D. | 15N的核外电子数与中子数不相同 |
16.在下列各氧化还原反应中,水既不作氧化剂,也不作还原剂的是( )
| A. | 2F2+2H2O═4HF+O2 | B. | 2Al+2H2O+2NaOH═2NaAlO2+3H2↑ | ||
| C. | 2K+2H2O═2KOH+H2↑ | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
13.用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是( )
| A. | 配制标准溶液的氢氧化钠中混有氯化钠杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其它操作均正确 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 | |
| D. | 碱式滴定管尖嘴部分的气泡没全部赶跑 |
20.下列说法正确的是( )
| A. | 强弱电解质的区别是溶液的导电能力大小 | |
| B. | 溶液与胶体的本质区别是有无丁达尔效应 | |
| C. | 相同条件下,等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| D. | 约含6.02×1023个Na+的Na2O2投入水中配成1L溶液,Na+的物质的量浓度为1mol/L |
10.下列叙述正确的是( )
| A. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| B. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中c(Cl-)+c(H+)<c(NH4+)+c(OH-) | |
| C. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)前者小于后者 | |
| D. | Na2CO3溶液加入少量Ca(OH)2固体,CO32-水解成都减小,溶液的pH减小 |
