题目内容
1.甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).
(1)分析该反应并回答下列问题:
①平衡常数表达式为K=$\frac{c{(CH}_{3}OH)}{c(CO){•c}^{2}{H(}_{2})}$.
②下列各项中,不能够说明该反应已达到平衡的是d(填序号).
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1mol CO,同时生成1mol CH3OH
(2)图1是该反应在不同温度下CO的转化率随时间变化的曲线.

①该反应的焓变△H<0(填“>”、“<”或“=”).
②T1和T2温度下的平衡常数大小关系是K1>K2(填“>”、“<”或“=”).
③若容器容积不变,下列措施可增加甲醇产率的是b.
a.升高温度b.将CH3OH(g)从体系中分离
c.使用合适的催化剂d.充入He,使体系总压强增大
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-a kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-b kJ•mol-1
③H2O(g)=H2O(l)△H=-c kJ•mol-1
则,CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-(0.5a+2c-0.5b)kJ•mol-1.
(4)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图2所示.
①该电池工作时,b口通入的物质为甲醇,c口通入的物质为氧气.
②该电池正极的电极反应式为:O2+4e-+4H+=2H2O.
分析 (1)①平衡常数指平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
②可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;
(2)①根据先拐先平数值大原则,由图1可知,温度T1<T2,平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动;
②升高温度,平衡向逆反应移动,平衡常数减小;
③提高甲醇产率,应采取措施使平衡向正反应移动,结合平衡移动原理分析;
(3)已知:①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H=-a kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-b kJ•mol-1
③H2O(g)=H2O(1)△H=-c kJ•mol-1
由盖斯定律可知,[①-②+③×4]÷2可得:CH3OH(1)+O2(g)=CO(g)+2H2O(l);
(4)由质子的定向移动可知左侧电极为燃料电池的负极,右侧电极为燃料电池的正极,负极发生氧化反应,甲醇在负极放电,正极反应还原反应,氧气在正极获得电子,与通过质子交换膜的氢离子结合生成水,负极电极反应式为:CH3OH(l)+H2O(l)-6e-=CO2(g)+6H+,正极反应式为O2+4e-+4H+=2H2O.
解答 解:(1)①可逆反应:CO(g)+2H2(g)?CH3OH(g)的平衡常数k=$\frac{c{(CH}_{3}OH)}{c(CO){•c}^{2}{H(}_{2})}$,
故答案为:$\frac{c{(CH}_{3}OH)}{c(CO){•c}^{2}{H(}_{2})}$;
②a.随反应进行,气体的物质的量减小,容器内压强减小,容器内的压强不发生变化,说明到达平衡状态,故a正确;
b.CH3OH分解的速率和CH3OH生成的速率相等,说明正逆反应速率相等,说明到达平衡状态,故b正确;
c.平衡时各组分的浓度、含量不变,说明到达平衡状态,故c正确;
d.一定条件下,单位时间内消耗1mol CO,同时生成1molCH3OH,都表示正反应速率,自始至终都按此比例进行,不能说明到达平衡状态,故d错误.
故答案为:d;
(2)①由图1可知,温度T1<T2,平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动,故该反应正反应为放热反应,则△H<0,故答案为:<;
②升高温度,平衡向逆反应移动,所以K1>K2,故答案为:>;
③a.升高温度,平衡向逆反应移动,甲醇产率降低,故a错误;
b.将CH3OH(g)从体系中分离,平衡向正反应移动,甲醇产率增大,故b正确;
c.使用合适的催化剂,缩短到达平衡时间,不影响平衡移动,甲醇产率不变,故c错误;
d.容器容积不变,充入He(g),使压强增大,但反应混合物的浓度不变,不影响平衡移动,甲醇产率不变,故d错误,
故答案为:b;
(3)已知:①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H=-a kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-b kJ•mol-1
③H2O(g)=H2O(1)△H=-c kJ•mol-1
由盖斯定律可知,[①-②+③×4]÷2可得:CH3OH(1)+O2(g)=CO(g)+2H2O(l)△H=-(0.5a+2c-0.5b) kJ•mol-1
故答案为:-(0.5a+2c-0.5b);
(4)由质子的定向移动可知左侧电极为燃料电池的负极,右侧电极为燃料电池的正极,负极发生氧化反应,甲醇在负极放电,正极反应还原反应,氧气在正极获得电子,与通过质子交换膜的氢离子结合生成水,
①该电池工作时,b口通入的物质为甲醇,c口通入的物质为氧气,
故答案为:甲醇;氧气;
②该电池正极的电极反应式为:O2+4e-+4H+=2H2O,
故答案为:O2+4e-+4H+=2H2O.
点评 本题考查平衡常数、平衡状态判断、化学平衡移动及图象、热化学方程式书写、原电池等,难度中等,需要学生具备扎实的基础与灵活运用能力.

 名校课堂系列答案
名校课堂系列答案| A. | 25℃和101kp的条件下,4.9L甲烷完全燃烧生成的水的分子数为0.4NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | Na2O2与足量H2O反应生成标况下11.2LO2,转移电子的数目为2 NA | |
| D. | 标准状况下,2.24LHF中所含电子数为NA |
| 选项 | 实验目的 | 实验方案 |
| A | 验证苯与液溴在溴化铁催化条件下发生的是取代反应 | 将产生的气体物质通入水中,滴入石蕊试液 |
| B | 检验火柴头中氯元素的存在 | 取几根火柴头浸入水中,片刻后再取少量溶液于试管中,滴加硝酸银溶液和稀硝酸 |
| C | 验证Ksp(AgI)<Ksp(AgCl) | 向1L浓度均为0.5mol•L-1NaCl、KI的混合液中滴加AgNO3溶液 |
| D | 配置0.1000mol•L-1CuSO4溶液 | 将12.00g CuSO4•5H20溶于水配成480mL溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 无水氯化钙 | B. | 无水硫酸镁 | C. | 金属钠 | D. | 金属镁 |
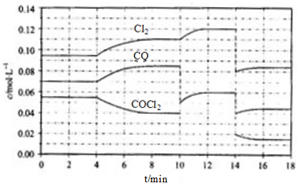 COCl2的分解反应为COCl2(g)?Cl2(g)+CO(g)△H=+108kJ•mol-1.反应体系平衡后,各物质的浓度在不同条件下的变化状况如下图(第10min到14min的COCl2浓度变化曲线未示出):
COCl2的分解反应为COCl2(g)?Cl2(g)+CO(g)△H=+108kJ•mol-1.反应体系平衡后,各物质的浓度在不同条件下的变化状况如下图(第10min到14min的COCl2浓度变化曲线未示出):