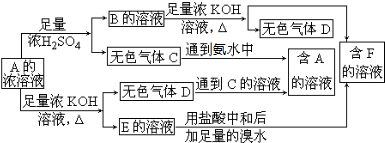
题目内容
16.在下列各氧化还原反应中,水既不作氧化剂,也不作还原剂的是( )| A. | 2F2+2H2O═4HF+O2 | B. | 2Al+2H2O+2NaOH═2NaAlO2+3H2↑ | ||
| C. | 2K+2H2O═2KOH+H2↑ | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
分析 水既不作氧化剂也不作还原剂的氧化还原反应中,含元素的化合价变化,但水中H、O元素的化合价不变,以此来解答.
解答 解:A.水中O元素的化合价升高,水为还原剂,故A不选;
B.反应中H元素化合价降低,水为氧化剂,故B不选;
C.反应中H元素化合价降低,水为氧化剂,故C不选;
D.Na2O2和H2O反应,Na2O2中-1价的O化合价既升高又降低,所以Na2O2既为还原剂又为氧化剂,水既不作氧化剂也不作还原剂,故D选.
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化剂、还原剂判断的考查,题目难度不大.

练习册系列答案
相关题目
6.一定条件下进行反应:COCl2(g)?Cl2(g)+CO(g),向2.0L恒容密闭容器中充入1.0mol COCl2(g),经过一段时间后达到平衡.反应过程中测得的有关数据见表:
下列说法正确的是(
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A. | 保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol•L-1,则反应的△H<0 | |
| B. | 若在2 L恒容绝热(与外界无热量交换)密闭容器中进行该反应,化学平衡常数改变 | |
| C. | 保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO, 反应达到平衡前的速率:v(正)>v(逆) | |
| D. | 保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60% |
4.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 25℃和101kp的条件下,4.9L甲烷完全燃烧生成的水的分子数为0.4NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | Na2O2与足量H2O反应生成标况下11.2LO2,转移电子的数目为2 NA | |
| D. | 标准状况下,2.24LHF中所含电子数为NA |
11.工业上一般在恒容密闭容器中可以采用下列反应合成甲醇
CO(g)+2H2(g)?CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同)CD.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(2)如表所列数据是反应在不同温度下的化学平衡常数(K).
①由表中数据判断该反应的△H<0(填“>”、“=”或“<”);
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃.
(3)要提高CO的转化率,可以采取的措施是df.
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
(4)一定条件下,CO与H2在催化剂的作用下生成5molCH3OH的能量变化为454kJ.在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
下列说法正确的是D.
A.2c1>c3 B.a+b<90.8 C.2p2<p3 D. α1+α3<1.
CO(g)+2H2(g)?CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同)CD.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(2)如表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃.
(3)要提高CO的转化率,可以采取的措施是df.
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
(4)一定条件下,CO与H2在催化剂的作用下生成5molCH3OH的能量变化为454kJ.在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 时 数 据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
A.2c1>c3 B.a+b<90.8 C.2p2<p3 D. α1+α3<1.
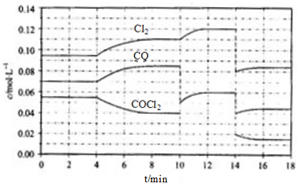 COCl2的分解反应为COCl2(g)?Cl2(g)+CO(g)△H=+108kJ•mol-1.反应体系平衡后,各物质的浓度在不同条件下的变化状况如下图(第10min到14min的COCl2浓度变化曲线未示出):
COCl2的分解反应为COCl2(g)?Cl2(g)+CO(g)△H=+108kJ•mol-1.反应体系平衡后,各物质的浓度在不同条件下的变化状况如下图(第10min到14min的COCl2浓度变化曲线未示出):