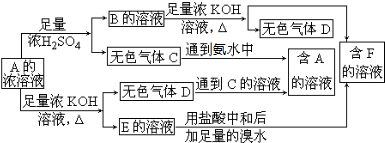
题目内容
10.下列叙述正确的是( )| A. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| B. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中c(Cl-)+c(H+)<c(NH4+)+c(OH-) | |
| C. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)前者小于后者 | |
| D. | Na2CO3溶液加入少量Ca(OH)2固体,CO32-水解成都减小,溶液的pH减小 |
分析 A.碳酸氢根离子的酸性大于氢氧化铝,二者反应生成氢氧化铝沉淀和碳酸氢根离子,没有气体生成;
B.氨水为弱碱,混合液呈碱性,则c(H+)<c(OH-),根据电荷守恒可知c(Cl-)<c(NH4+);
C.溶液的pH相同,则氢离子浓度相同;
D.碳酸根离子浓度减小,但是反应生成了氢氧化钠,溶液的碱性增强、pH增大.
解答 解:A.NaHCO3溶液与NaAlO2溶液,反应中碳酸氢钠提供氢离子与偏铝酸根反应生成生成碳酸根离子和Al(OH)3,没有气体生成,故A错误;
B.室温下,pH=2的盐酸与pH=12的氨水等体积混合,氨水过量,混合液呈碱性,则c(H+)<c(OH-),根据电荷守恒可知c(Cl-)<c(NH4+),则所得溶液中c(Cl-)+c(H+)<c(NH4+)+c(OH-),故B正确;
C.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液,由于溶液的pH相同,则两溶液中的c(H+)相同,故C错误;
D.Na2CO3溶液加入少量Ca(OH)2固体,反应生成碳酸钙沉淀和氢氧化钠,碳酸根离子浓度减小,则CO32-水解程度减小,由于反应生成了氢氧化钠,则溶液的pH增大,故D错误;
故选B.
点评 本题考查了盐的水解原理及其应用,题目难度中等,明确盐的水解原理为解答关键,涉及离子浓度大小比较、溶液酸碱性与溶液pH的计算、盐的水解原理等知识,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
20.为了应对能源危机,满足不断增大的能源需求,当今国际能源研究的另一热点就是寻找新的能源.下列属于新能源的是( )
①太阳能 ②氢能 ③石油 ④海洋能 ⑤生物质能 ⑥天然气.
①太阳能 ②氢能 ③石油 ④海洋能 ⑤生物质能 ⑥天然气.
| A. | ①②④⑥ | B. | ①②④⑤ | C. | ①②③⑤ | D. | ①②③④⑤⑥ |
15.目前用14C呼气试验来检查幽门螺杆菌,从而达到检测和预防胃溃疡、慢性胃炎、胃癌的目的,下列说法正确的是( )
| A. | 14CO2的结构式为O═14C═O | B. | 14CO2和12CO2互为同分异构体 | ||
| C. | 14C和12C互为同素异形体 | D. | 14CO2和Na218O2反应生成15O2 |
2.下列实验方案设计中,能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 验证苯与液溴在溴化铁催化条件下发生的是取代反应 | 将产生的气体物质通入水中,滴入石蕊试液 |
| B | 检验火柴头中氯元素的存在 | 取几根火柴头浸入水中,片刻后再取少量溶液于试管中,滴加硝酸银溶液和稀硝酸 |
| C | 验证Ksp(AgI)<Ksp(AgCl) | 向1L浓度均为0.5mol•L-1NaCl、KI的混合液中滴加AgNO3溶液 |
| D | 配置0.1000mol•L-1CuSO4溶液 | 将12.00g CuSO4•5H20溶于水配成480mL溶液 |
| A. | A | B. | B | C. | C | D. | D |
7.NaCl是一种化工原料,可以制备一系列物质(见图).下列说法正确的是( )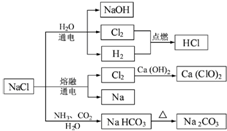

| A. | 25℃,NaHCO3在水中的溶解度比Na2CO3的大 | |
| B. | 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 | |
| C. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| D. | 图中所示转化反应不都是氧化还原反应 |