题目内容
7.电解KCL和NaNO3溶液可以得到KNO3溶液,电解装置如图所示,以下说法正确的是( )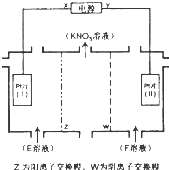
| A. | X为负极,F溶液NaNO3溶液 | |
| B. | 电解一段时间,往Pt片(I)附近滴入酚酞,溶液变红 | |
| C. | 电解总反应方程式为:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | |
| D. | 理论上,当得到0.1molKNO3时,Pt片(Ⅱ)上生成标准状况下为1.12L的气体 |
分析 电解KCL和NaNO3溶液可以得到KNO3溶液,依据图中硝酸钾的出处可知结合Z为阳离子交换膜可知,E为氯化钾溶液,F为硝酸钠溶液,阴极为氯离子放电,阳极为氢离子放电,氯离子在Pt片(I)阳极发生氧化反应失去电子生成氯气,阴极氢离子在Pt片(Ⅱ)得到电子发生还原反应生成氢气,据此分析解答.
解答 解:电解KCL和NaNO3溶液可以得到KNO3溶液,依据图中硝酸钾的出处可知结合Z为阳离子交换膜可知,E为氯化钾溶液,F为硝酸钠溶液,阴极为氯离子放电,阳极为氢离子放电,氯离子在Pt片(I)阳极发生氧化反应失去电子生成氯气,阴极氢离子在Pt片(Ⅱ)得到电子发生还原反应生成氢气,
A.由上述分析可知E为氯化钾溶液,氯离子在Pt片(I)发生氧化反应,Pt片(I)为阳极,则X为正极,故A错误;
B.氯离子在Pt片(I)发生氧化反应生成氯气逸出,水电离产生的氢离子在Pt片(Ⅱ)得到电子发生还原反应生成氢气,则Pt片(Ⅱ)附近氢氧根离子浓度大于氢离子浓度,显碱性,加入酚酞溶液显红色,故B错误;
C.阴极为氯离子放电,阳极为氢离子放电,氯离子在Pt片(I)阳极发生氧化反应失去电子生成氯气,阴极氢离子在Pt片(Ⅱ)得到电子发生还原反应生成氢气,电解方程式为:H2O+2KCl$\frac{\underline{\;通电\;}}{\;}$2KOH+H2↑+Cl2↑,故C错误;
D.当得到0.1molKNO3时,则有0.1mol钾离子透过阳离子交换膜,则转移0.1mol电子,阳极电极反应式:
2Cl--2e-=Cl2↑,转移0.1mol电子生成0.05mol氯气,标况下体积为0.05mol×22.4L/mol=1.12L,
故D正确;
故选:D.
点评 本题考查了电解池工作原理,明确电解池工作原理、准确判断电解池电极及放电离子是解题关键,题目难度中等.

①
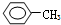
②
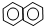
③
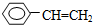
④C2H4
⑤CH2=CH-CH=CH2
⑥C3H6
⑦
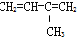
⑧
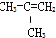
| A. | ④和⑥ | B. | ①、②和③ | C. | ⑤和⑦ | D. | ⑥和⑧ |
| A. | 常见单质的沸点:W>Y>Z | |
| B. | W的氢化物为共价化合物 | |
| C. | 原子半径:Y<Z<W | |
| D. | X、Y可以形成既有极性键也有非极性键的化合物 |
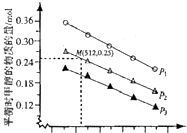
Ⅰ.减少二氧化碳的排放是一项重要课题.研究表明,C02经催化加氢可合成低碳醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H几种化学键的键能如表所示
| 化学键 | C=0 | H-H | C-C | C-H | 0-H | C-0 |
| 键能/kJ•mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
(2)在1.0L恒容密闭容器中投入lmolC02和2.75molH2发生该反应,实验测得不同温度及压强下,平衡时甲醉的物质的量如图所示.
当压强为P2,温度为512K时,向该容器中投入 lmol CO2、0.5mol H2、2mol CH3OH、0.6mol H20时,平衡向逆反应方向移动.
(3)以CH3OH、空气(02含量20%)、KOH溶液为 原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为CH3OH+8OH--6e-=CO32-+6H2O;用该 电池电解500mL 1mol/L CuSO4溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量1mol.
Ⅱ.SO2也是一种大气污染物,可以用海水处理含SO2的废气,海水中主要离子的含量如下:
| 成分 | 含量/(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3-; | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
已知Ksp[Mg(OH)2]=1.2×l0-11 Ksp[Ca(OH)2]=5.5×10-6
(2)处理过的废气中S02的含量可以通过碘量法来测定.用到的试剂有:0.l mol•L的碘标准溶液,淀粉溶液.当把处理后的废气以每分钟aL(标况下)的流速通入到lOOmL含有淀粉的碘标准液中,t min达到滴定终点.滴定终点的现象为溶液蓝色褪去,且半分钟不恢复颜色计算该处理气中SO2的含量$\frac{0.224}{at}$(用含a,t的式子表示)
 25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随c(HC2O4)的变化趋势如下图所示.下列说法正确的是( )
25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随c(HC2O4)的变化趋势如下图所示.下列说法正确的是( )| A. | 当c(HC2O4ˉ)=0.1mol•Lˉ1时,c(H+)>c(C2O42-)-c(H2C2O4) | |
| B. | 当c(HC2O4ˉ)>amol•Lˉ1时,c(H+)<c(H2C2O4),HC2O4ˉ的水解程度大于电离程度 | |
| C. | HC2O4ˉ?C2O42-+H+,Ka(HC2O4ˉ)=a | |
| D. | 将0.08mol•Lˉ1H2C2O4溶液与等浓度NaOH溶液等体积混合后(忽略体积变化),c(Na+)>c(HC2O4ˉ)>c(C2O42-)>c(H2C2O4)>c(H+)>c(OHˉ) |
(1)已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
| 气化反应式 | 1gK | ||
| 700K | 900K | 1200K | |
| C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
(2)业上合成甲醇的反应为:CO+2H2?CH3OH.已知:H2(g)、CO(g)、CH3OH(l)的燃烧热△H分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.则:CH3OH(l)不完全燃烧生成CO和液态H2O的热化学反应方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l);△H=-443.5kJ/mol.
(3)在一定温度、压强和催化条件下,工业上用H2CO和CO合成CH3OCH3:
3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-246.4KJ•mol-1
①在一定条件下的密闭容器中,该反应达到平衡,只改变一个条件能同时提高反应速率和CO的转化率的是cd(填字母序号).
a.降低温度 b.加入催化剂 c.缩小容器体积 d.增加H2的浓度 e.增加CO的浓度
②在一体积可变的密闭容器中充入3molH2、3molCO、1molCH3OCH3、1molCO2,在一定温度和压强下发生上述反应,经一定时间达到平衡,测得平衡时混合气体的密度是同温同压下起始的1.6倍.反应开始时正、逆反应速率的大小:v正>v逆(填“>”“<”或“=”),平衡时CO的物质的量分数为15%.
(4)一定条件下可用甲醇与CO反应生成醋酸消除CO污染,常温下,将amol•L-1的醋酸与bmol•L-1的Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=$\frac{2b}{a-2b}$×10-7 mol•L-1(用含a和b的代数式表示,体积变化忽略不计).
| A. | 按熔点由低到高排列I2、CO2、Hg、KCl、SiO2 | |
| B. | 在石英晶体中,每个硅原子和相邻的两个氧原子以共价键结合 | |
| C. | 有机物分子中碳原子成键方式和排列方式有多种以及同分异构现象的存在都是有机物种类繁多的原因 | |
| D. | 因为石墨是金刚石的同素异形体,所以二者空间结构相似,化学性质相似 |
 表示的分子式为C6H14;名称是2-甲基戊烷.
表示的分子式为C6H14;名称是2-甲基戊烷.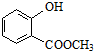 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.