题目内容
1.下列有关叙述正确的是( )| A. | 按熔点由低到高排列I2、CO2、Hg、KCl、SiO2 | |
| B. | 在石英晶体中,每个硅原子和相邻的两个氧原子以共价键结合 | |
| C. | 有机物分子中碳原子成键方式和排列方式有多种以及同分异构现象的存在都是有机物种类繁多的原因 | |
| D. | 因为石墨是金刚石的同素异形体,所以二者空间结构相似,化学性质相似 |
分析 A.晶体熔沸点:原子晶体>离子晶体>分子晶体,不含氢键的分子晶体熔沸点与其相对分子质量成正比;
B.在石英晶体中,每个Si原子和四个O原子相连,每个O原子和两个Si原子相连;
C.碳原子能形成四个共价键,且碳原子和其它非金属元素及自身能形成共价键,形成的碳链结构有直链状、环状;
D.同素异形体化学性质相似,物理性质不同.
解答 解:A.晶体熔沸点:原子晶体>离子晶体>分子晶体,不含氢键的分子晶体熔沸点与其相对分子质量成正比,I2、CO2为分子晶体,Hg为金属晶体,KCl为离子晶体,SiO2为原子晶体,所以熔沸点SiO2>KCl>I2>Hg>CO2,故A错误;
B.在石英晶体中,每个Si原子和四个O原子相连,每个O原子和两个Si原子相连,故B错误;
C.碳原子能形成四个共价键,且碳原子和其它非金属元素及自身能形成共价键,形成的碳链结构有直链状、环状,所以有机物分子中碳原子成键方式和排列方式有多种以及同分异构现象的存在都是有机物种类繁多的原因,故C正确;
D.同素异形体化学性质相似,物理性质不同,金刚石为空间网状结构、石墨为层状结构,故D错误;
故选C.
点评 本题考查晶体熔沸点比较、碳的成键特点、同素异形体等知识点,为高频考点,侧重考查学生对物质结构、性质的比较判断,注意A中Hg晶体熔沸点,为易错点.

练习册系列答案
相关题目
7.电解KCL和NaNO3溶液可以得到KNO3溶液,电解装置如图所示,以下说法正确的是( )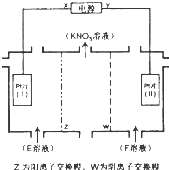

| A. | X为负极,F溶液NaNO3溶液 | |
| B. | 电解一段时间,往Pt片(I)附近滴入酚酞,溶液变红 | |
| C. | 电解总反应方程式为:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | |
| D. | 理论上,当得到0.1molKNO3时,Pt片(Ⅱ)上生成标准状况下为1.12L的气体 |
9.下列反应能用离子方程式CO32-+Ba2+═BaCO3↓表示的有( )
| A. | BaCl2与K2CO3溶液反应 | B. | CO2与Ba(OH)2溶液反应 | ||
| C. | Ba(NO3)2与Na2CO3溶液反应 | D. | Ba(OH)2与少量NaHCO3溶液反应 |
16.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:Mg2+、Al3+、NO3-、Cl- | |
| B. | 使pH试纸显蓝色的溶液中:NH4+、NO3-、SO42-、Na+ | |
| C. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:Mg2+、K+、Cl-、NO3- | |
| D. | pH=0的溶液中:K+、Fe3+、SO42-、SCN- |
10.如图甲所示,纯电动公交车逐渐成为杭州街头常见的身影,磷酸铁锂电池是杭州市纯电动公交车所用的电池,现要从废旧磷酸铁锂电池中回收Fe、Al、Li等物质,采用图乙所示方法.已知:磷酸铁锂电池溶解在H2SO4中含有Fe3+、Al3+、Li+、SO42-、PO43-等离子及少量不溶物,滤液c中含有大量Li+离子,Li2CO3可溶于冷水,不溶于热水.下列说法不正确的是( )
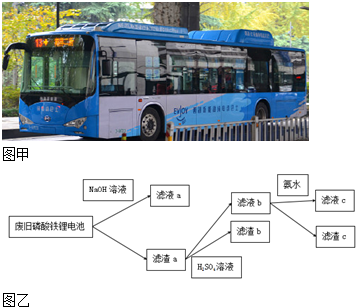

| A. | 向滤液a中加入适量H2SO4溶液,可以得到白色沉淀 | |
| B. | 滤液b中加入氨水的目的是使Fe3+沉淀,滤渣c为红褐色 | |
| C. | 要将Li从溶液中析出,可在滤液c中加入足量Na2CO3溶液,加热浓缩,冷却结晶 | |
| D. | 图中的氨水可以用适量NaOH溶液代替 |
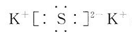 ,A属于离子化合物.
,A属于离子化合物. .其基态原子有7种能量不同的电子;
.其基态原子有7种能量不同的电子;
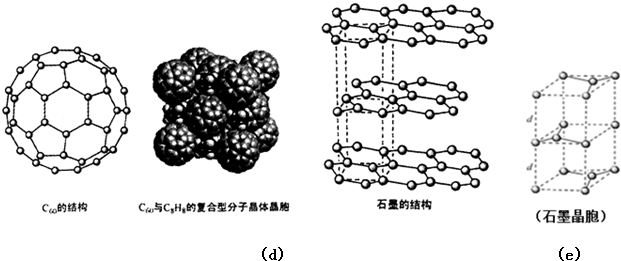
 )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图(d)所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图(d)所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60