题目内容
6.对于可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )| A. | 达到化学平衡状态时,4v正(O2)=5V逆(NO) | |
| B. | 化学反应速率的关系为2V正(NH3)=3V正(H2O) | |
| C. | 达到化学平衡状态时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到化学平衡状态 |
分析 A、达到化学平衡时,化学反应速率是相等的,且反应速率之比等于方程式的系数之比;
B、速率之比等于对应物质的化学计量数之比;
C、若增加容器体积,相当于减小压强,正逆反应速率都减小;
D、达到化学平衡时,化学反应的正逆反应速率是相等的.
解答 解:A、4v正(O2)=5v逆(NO)能证明化学反应的正逆反应速率是相等的,达到了化学平衡状态,故A正确;
B、速率之比等于对应物质的化学计量数之比,所以化学反应速率的关系为3V正(NH3)=2V正(H2O),故B错误;
C、若增加容器体积,相当于减小压强,正逆反应速率都减小,故C错误;
D、单位时间内生成x mol NO,同时消耗x mol NH3,则不能说明化学反应的正逆反应速率是相等的,只表示了正反应方向,故D错误;
故选A.
点评 本题考查化学平衡状态的判断、化学平衡移动的方向以及影响因素是现在考查的热点,注意知识的归纳和整理,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.在2A+B?3C+5D反应中,表示该反应速率最快的是( )
| A. | V(A)=2.0mol/(L•s) | B. | V(B)=1.2mol/(L•s) | C. | V(C)=3.2mol/(L•s) | D. | V(D)=4.0 mol/(L•s) |
1.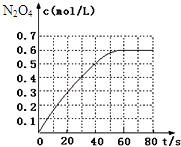 298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)?N2O4(g)△H=-a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图.达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时,下列大小关系正确的是( )
298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)?N2O4(g)△H=-a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图.达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时,下列大小关系正确的是( )
 298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)?N2O4(g)△H=-a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图.达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时,下列大小关系正确的是( )
298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)?N2O4(g)△H=-a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图.达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时,下列大小关系正确的是( )| A. | v(正)>v(逆) | B. | v(正)<v(逆) | ||
| C. | v(正)=v(逆) | D. | v(正)、v(逆)大小关系不确定 |
9.25℃时,在pH=1的溶液中可以大量共存的离子组是( )
| A. | K+、Na+、HCO3-、NO3- | B. | Na+、K+、SO42-、Cl- | ||
| C. | Ba2+、Mg2+、SO42-、NO3- | D. | Fe2+、K+、NO3-、Na+ |
16.向含FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的Na2O2固体后,再加入过量的稀盐酸,溶液中离子数目不发生变化的是( )
| A. | Na+ | B. | Al3+ | C. | Fe3+ | D. | Fe2+ |
 D.△H4 = 3/2(△H1 -△H2 - 3△H3)
D.△H4 = 3/2(△H1 -△H2 - 3△H3) .乙的单质的电子式为
.乙的单质的电子式为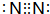 .
.