题目内容
20.短周期元素A、B、C、D、E、F、G原子序数依次递增,已知A和D,C和G为同一主族元素,D形成的阳离子和C形成的阴离子具有相同的核外电子排布,B原子的最外层电子数比次外层多3,G形成的化合物甲是造成酸雨的主要原因,F和A可形成化合物FA4很不稳定,F与C形成的化合物是制造光导纤维的主要原料,E的最高价氧化物的水化物能溶解于D的最高价氧化物的水化物中.请回答下列问题:(1)写出 E的最高价氧化物水化物的电离方程式AlO2-+H++H2O?Al(OH)3?Al3++3OH-
(2)画出G离子的结构示意图

(3)写出E的最高价氧化物的水化物溶解于D的最高价氧化物的水化物的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(4)化合物甲的治理方法之一是用软锰矿浆(主要成分为MnO2)吸收法,该方法能做到“综合治理、变废为宝”,请写出其反应的化学方程式SO2+MnO2=MnSO4
(5)已知一包白色晶体为某种正盐,经元素分析仪分析,包含以上七种元素中的若干种,为测定其组成,进行如下实验:
①称取固体2.37g溶于水,得到无色澄清溶液,再滴加过量的氯化钡溶液和稀盐酸,得到的白色沉淀经过滤、洗涤、干燥后,称得质量为4.66g
②再取等质量的该固体溶于水,逐滴滴加1mol/L的氢氧化钠溶液,得到的沉淀和滴加的氢氧化钠溶液体积的关系如图:
 ,
,盐的化学式为NH4Al(SO4)2;往该盐的水溶液中滴加氢氧化钡溶液时可得到沉淀,请写出生成沉淀质量达到最大值的离子方程式Al3++NH4++2SO42-+2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+NH3.H2O.
分析 短周期元素A、B、C、D、E、F、G原子序数依次递增,B原子的最外层电子数比次外层多3,原子只能有2个电子层,最外层电子数为5,故B为N元素;F与C形成的化合物是制造光导纤维的主要原料,则C为O元素、F为Si;C和G为同一主族元素,则G为S元素;D形成的阳离子和C(氧)形成的阴离子具有相同的核外电子排布,D处于第三周期,A和D为同一主族元素,F(Si)和A可形成化合物FA4很不稳定,可推知A为H元素、D为Na;D的最高价氧化物的水化物为NaOH,E的最高价氧化物的水化物能溶解于NaOH溶液,E的原子序数介于Na、Si之间,则E为Al,G形成的化合物甲为SO2是造成酸雨的主要原因.
(1)E的最高价氧化物水化物为Al(OH)3,存在酸性电离与碱式电离;
(2)G离子为S2-,离子核外有18个电子,有3个电子层,各层电子数为2、8、8;
(3)E的最高价氧化物的水化物为Al(OH)3,D的最高价氧化物的水化物为NaOH,二者反应生成偏铝酸钠与水;
(4)G形成的化合物甲为SO2,与MnO2反应生成MnSO4;
(5)已知一包白色晶体为某种正盐,经元素分析仪分析,包含以上七种元素中的若干种,为测定其组成,进行如下实验:
①称取固体2.37g溶于水,得到无色澄清溶液,再滴加过量的氯化钡溶液和稀盐酸,得到的白色沉淀,则含有SO42-,白色沉淀为BaSO4,其物质的量为$\frac{4.66g}{233g/mol}$=0.02mol,则溶液中n(SO42-)=n(BaSO4)=0.02mol;
②再取等质量的该固体溶于水,逐滴滴加1mol/L的氢氧化钠溶液,开始生成沉淀,最终沉淀完全溶解,则含有Al3+,30mL~40mL时氢氧化铝质量不变,则溶液中还含有NH4+,由Al3++3OH-=Al(OH)3↓可知溶液中n(Al3+)=0.03L×1mol/L×$\frac{1}{3}$=0.01mol,由NH4++OH-=NH3.H2O可知溶液中n(NH4+)=0.01L×1mol/L=0.01mol,m(SO42-)+m(Al3+)+m(NH4+)=0.02mol×96g/mol/L+0.01mol×27g/mol+0.01mol×18g/mol=2.37g,等于样品的质量,故该晶体不含结晶水,晶体中n(SO42-):n(Al3+):n(NH4+)=0.02mol:0.01mol:0.01mol=2:1:1,故该晶体为NH4Al(SO4)2,
往该盐的水溶液中滴加氢氧化钡溶液时,NH4Al(SO4)2与氢氧化钡按物质的量1:2反应时生成沉淀质量达到最大值.
解答 解:短周期元素A、B、C、D、E、F、G原子序数依次递增,B原子的最外层电子数比次外层多3,原子只能有2个电子层,最外层电子数为5,故B为N元素;F与C形成的化合物是制造光导纤维的主要原料,则C为O元素、F为Si;C和G为同一主族元素,则G为S元素;D形成的阳离子和C(氧)形成的阴离子具有相同的核外电子排布,D处于第三周期,A和D为同一主族元素,F(Si)和A可形成化合物FA4很不稳定,可推知A为H元素、D为Na;D的最高价氧化物的水化物为NaOH,E的最高价氧化物的水化物能溶解于NaOH溶液,E的原子序数介于Na、Si之间,则E为Al,G形成的化合物甲为SO2是造成酸雨的主要原因.
(1)E的最高价氧化物水化物为Al(OH)3,电离方程式为:AlO2-+H++H2O?Al(OH)3?Al3++3OH-,
故答案为:AlO2-+H++H2O?Al(OH)3?Al3++3OH-;
(2)G离子为S2-,离子结构示意图为 ,
,
故答案为: ;
;
(3)E的最高价氧化物的水化物为Al(OH)3,D的最高价氧化物的水化物为NaOH,二者反应生成偏铝酸钠与水,反应离子方程式:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)G形成的化合物甲为SO2,化合物甲的治理方法之一是用软锰矿浆(主要成分为MnO2)吸收法,该方法能做到“综合治理、变废为宝”,其反应的化学方程式:SO2+MnO2=MnSO4,
故答案为:SO2+MnO2=MnSO4;
(5)已知一包白色晶体为某种正盐,经元素分析仪分析,包含以上七种元素中的若干种,为测定其组成,进行如下实验:
①称取固体2.37g溶于水,得到无色澄清溶液,再滴加过量的氯化钡溶液和稀盐酸,得到的白色沉淀,则含有SO42-,白色沉淀为BaSO4,其物质的量为$\frac{4.66g}{233g/mol}$=0.02mol,则溶液中n(SO42-)=n(BaSO4)=0.02mol;
②再取等质量的该固体溶于水,逐滴滴加1mol/L的氢氧化钠溶液,开始生成沉淀,最终沉淀完全溶解,则含有Al3+,30mL~40mL时氢氧化铝质量不变,则溶液中还含有NH4+,由Al3++3OH-=Al(OH)3↓可知溶液中n(Al3+)=0.03L×1mol/L×$\frac{1}{3}$=0.01mol,由NH4++OH-=NH3.H2O可知溶液中n(NH4+)=0.01L×1mol/L=0.01mol,m(SO42-)+m(Al3+)+m(NH4+)=0.02mol×96g/mol/L+0.01mol×27g/mol+0.01mol×18g/mol=2.37g,等于样品的质量,故该晶体不含结晶水,晶体中n(SO42-):n(Al3+):n(NH4+)=0.02mol:0.01mol:0.01mol=2:1:1,故该晶体为NH4Al(SO4)2,
往该盐的水溶液中滴加氢氧化钡溶液时,NH4Al(SO4)2与氢氧化钡按物质的量1:2反应时生成沉淀质量达到最大值,反应离子方程式为:Al3++NH4++2SO42-+2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+NH3.H2O,
故答案为:NH4Al(SO4)2;Al3++NH4++2SO42-+2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+NH3.H2O.
点评 本题考查结构性质位置关系应用、无机物推断等,侧重考查学生分析推理能力、知识迁移运用能力,(6)中关键是根据反应判断溶液中含有的离子,难度较大.

| A. | 电镀铜时,电解质溶液中铜离子浓度不断减小 | |
| B. | 电解精炼铜时,电解质溶液中铜离子浓度不变 | |
| C. | 纯锌与稀硫酸反应时,加入少量CuSO4溶液,会使反应速率减慢 | |
| D. | 要使电解后的CuSO4溶液复原,可向其中加人CuO固体 |
| A. | 含有NA个二氧化碳分子 | B. | 含有1molO2 | ||
| C. | 质量为44 g•mol-1 | D. | 所占的体积为22.4L |
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1;
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1;
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1.
则氨的催化氧化反应的热化学方程式为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905kJ/mol.
(2)汽车尾气净化的一个反应原理为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0.一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图1所示.
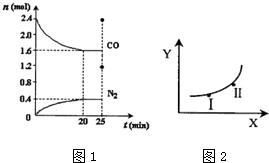
①NO的平衡转化率为28.57%,0~20min平均反应速率v(NO)为0.02mol/(L•min).25min时,若保持反应温度不变,再向容器中充入CO、N2各0.8mol,则化学平衡将向左移动(填“向左”、“向右”或“不”).
②如图2若只改变某一反应条件X,反应由原平衡I达到新平衡Ⅱ,变量Y的变化趋势如表所示.下列说法正确的是b (填字母代号).
| 条件X | 变量Y | |
| a | 压强 | 反应的平衡常数 |
| b | 温度 | CO的平衡浓度 |
| c | 温度 | N2的体积分数 |
| d | 催化剂 | NO的平衡转化率 |
a.放电过程中,电解质溶液的pH保持不变
b.溶液中的NH4Cl浓度增大,但Cl-离子浓度不变
c.每转移6.02×1023个电子,则有标准状况下11.2L电极反应物被氧化
d.为保持放电效果,电池使用一段时间需更换电解质溶液.
| A. | 0.5 mol 1,3-丁二烯分子中含有C=C双键数为 NA | |
| B. | 1 mol羟基(-OH)所含的电子总数为9NA | |
| C. | 14g乙烯、丙烯的混合气体中所含原子总数为3NA | |
| D. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为7/22.4NA |
| A. | 无论在什么条件下,c(H+)增大,酸性都增强 | |
| B. | 稀释氯化铵溶液,水的电离程度变大 | |
| C. | 稀释氢氧化钠溶液,水的电离程度变小 | |
| D. | 升高温度,KW变大,H+浓度增大 |
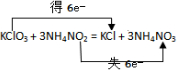 .
.