题目内容
11.已知 KClO3+3NH4NO2=KCl+3NH4NO3(1)指出以上反应中的氧化剂是KClO3被氧化的元素是N
(2)用双线桥标明电子转移的方向和数目
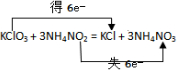 .
.
分析 KClO3+3NH4NO2=KCl+3NH4NO3中Cl元素的化合价由+5价降低为-1价,N元素的化合价由+3价升高为+5价,该反应转移6e-,以此来解答.
解答 解:(1)Cl元素的化合价降低,则氧化剂为KClO3;N元素失去电子被氧化,故答案为:KClO3;N;
(2)Cl元素的化合价由+5价降低为-1价,N元素的化合价由+3价升高为+5价,该反应转移6e-,用双线桥标明电子转移的方向和数目为 ,故答案为:
,故答案为: .
.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
2.如图下列仪器,可以直接加热的是( )
| A. |  | B. |  | C. |  | D. |  |
19.已知短周期元素的四种离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述中正确的是( )
| A. | 原子序数 d>c>b>a | |
| B. | 单质的还原性D<C<B<A | |
| C. | 离子半径 C3->D->B+>A2+ | |
| D. | A、B、C最高价氧化物对应水化物溶液(等物质的量浓度)的pH值C>B>A |
16.反应2SO2+O2$?_{△}^{催化剂}$2SO3经一段时间后,SO3的浓度增加了0.8mol•L-1,在这段时间内用O2表示的反应速率为0.04mol•L-1•s-1,则这段时间为( )
| A. | 0.1 s | B. | 2.5 s | C. | 5 s | D. | 10 s |

 ,
,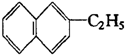 属于萘的同系物,则萘和萘的同系物分子组成通式为CnH2n-12 (n≥10).
属于萘的同系物,则萘和萘的同系物分子组成通式为CnH2n-12 (n≥10). ②丙的结构简式为
②丙的结构简式为 .
.