题目内容
11.下列说法正确的是( )| A. | 将FeCl3溶液加热蒸干,可得到FeCl3固体 | |
| B. | 配制FeSO4溶液时,为抑制Fe2+水解,先将FeSO4固体溶于稀硫酸中,然后稀释至所需浓度 | |
| C. | 将PH=9的KOH溶液稀释1000倍后,其PH=6 | |
| D. | 碳酸溶液中氢离子浓度是碳酸根离子浓度的二倍 |
分析 A.氯化铁是水解能生成挥发性的盐酸的盐;
B.硫酸亚铁水解显酸性;
C.将PH=9的KOH溶液无限稀释,溶液仍然是碱性的;
D.碳酸是弱酸,不能完全电离,二级电离远远小于一级电离.
解答 解:A.将氯化铁溶液加热蒸干,得到的是水解产物氢氧化铁,再灼烧,得到的是分解产物Fe2O3,故A错误;
B.硫酸亚铁水解显酸性,在溶液中加稀硫酸可以抑制亚铁离子的水解,所以配制FeSO4溶液时,为抑制Fe2+水解,先将FeSO4固体溶于稀硫酸中,然后稀释至所需浓度,故B正确;
C.将PH=9的KOH溶液稀释1000倍后,其pH接近于7,但是仍然大于7,故C错误;
D.碳酸是弱酸,不能完全电离,二级电离远远小于一级电离,氢离子浓度远大于碳酸根离子浓度的2倍,故D错误;
故选B.
点评 本题考查盐的水解原理应用、弱电解质电离、溶液的稀释等知识,C选项注意碱无限稀释接近中性的特点,题目难度不大,侧重于考查学生对基础知识的综合应用能力.

练习册系列答案
 同步奥数系列答案
同步奥数系列答案
相关题目
2.已知:SO32-+I2+H2O→SO42-+2I-+2H+.某溶液中可能含有Na+、NH4+、Fe2+、K+、I-、SO32-、SO42-,且所有离子物质的量浓度相等.向该无色溶液中滴加少量溴水,溶液仍呈无色.下列关于该溶液的判断正确的是( )
| A. | 肯定不含I- | B. | 肯定不含SO42- | C. | 肯定不含SO32- | D. | 肯定含有NH4+ |
19.化学在日常生活和生产中有着重要的应用.下列说法不正确的是( )
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为溶液中的SO32- 发生水解 | |
| C. | 将饱和FeCl3溶液滴入沸水中可制备Fe(OH)3胶体,利用的是盐类水解原理 | |
| D. | 纯碱溶液呈碱性的原因是CO3 2-+H2O?HCO3-+OH- |
6.下列有关概念的叙述中正确的是( )
| A. | 非金属氧化物一定都是酸性氧化物 | |
| B. | 碱性氧化物一定都是金属氧化物 | |
| C. | 既能与酸反应又能与碱反应的物质一定具有两性 | |
| D. | 氧化还原反应一定都是离子反应 |
16.下列8种有机物:①CH2═CH2 ②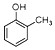 ③CH3OH ④CH3Cl ⑤CCl4⑥HCOOCH3 ⑦CH3COOCH2CH3 ⑧CH3COOH按物质类别不同可分为( )
③CH3OH ④CH3Cl ⑤CCl4⑥HCOOCH3 ⑦CH3COOCH2CH3 ⑧CH3COOH按物质类别不同可分为( )
 ③CH3OH ④CH3Cl ⑤CCl4⑥HCOOCH3 ⑦CH3COOCH2CH3 ⑧CH3COOH按物质类别不同可分为( )
③CH3OH ④CH3Cl ⑤CCl4⑥HCOOCH3 ⑦CH3COOCH2CH3 ⑧CH3COOH按物质类别不同可分为( )| A. | 4类 | B. | 5类 | C. | 6类 | D. | 8类 |
3.下列说法不正确的是( )
| A. | 25℃时Kw=1.0×10-14,将稀硫酸加热至90℃(忽略溶液体积变化)其pH不变 | |
| B. | pH与体积都相同的醋酸和硝酸溶液分别用0.1mol•L-1氢氧化钠溶液恰好中和,所需的氢氧化钠溶液体积前者一定大于后者 | |
| C. | 0.2 mol•L-1CH3COONa溶液和0.1mol•L-1盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(Cl-) | |
| D. | 向少量AgNO3溶液中滴加适量NaCl溶液,再滴加适量KI溶液,若开始有白色沉淀生成,后逐渐变为黄色沉淀,即说明Ksp(AgI)<Ksp(AgCl) |
20.在120℃,1.01×105Pa时,将3L炔烃和烷的混合气体与相同状态下的14LO2混合,充分燃烧烃/后恢复到原来状态时.所得气体的体积是17L.则下列各组烃的混合物中可能是( )
| A. | C2H4和C2H6 | B. | C3H4和CH4 | C. | C2H2和CH4 | D. | C4H6和C2H6 |
