题目内容
14.(1)2mol尿素[CO(NH2)2]中含4mol N原子、8NA个H原子,所含氧原子跟36g H2O所含氧原子个数相等.(2)3.6g NH4+中含2.0mol e-.
(3)含0.4mol Al2(SO4)3的溶液中,含1.2mol SO42-.
分析 (1)尿素的化学式中含有2个N原子,据此计算出2mol尿素含有N、O原子的物质的量,再根据N=nNA计算出含有H原子数;结合水分子的组成计算出需要水的物质的量及质量;
(2)根据n=$\frac{m}{M}$计算出铵根离子的物质的量,然后结合铵根离子中含有10个电子计算出含有电子的物质的量;
(3)结合硫酸铝的化学式组成计算出含有硫酸根离子的物质的量.
解答 解:(1)2mol尿素[CO(NH2)2]中含N的物质的量为:2mol×2=4mol;含有H的数目为:0.2mol×4×NAmol-1=8NA;2mol尿素[CO(NH2)2]中含O的物质的量为2mol,氧原子数相同时氧原子的物质的量相等,则需要水的物质的量为:$\frac{2mol}{1}$=2mol,质量为:18g/mol×2mol=36g,
故答案为:4;8NA;36;
(2)3.6g NH4+的物质的量为:$\frac{3.6g}{18g/mol}$=0.2mol,含电子的物质的量为:0.2mol×10=2.0mol,
故答案为:2.0;
(3)含0.4mol Al2(SO4)3的溶液中,含SO42-的物质的量为:n(SO42-)=3n[Al2(SO4)3]=0.4mol×3=1.2mol,
故答案为:1.2.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与阿伏伽德罗常数、摩尔质量等之间的关系为解答关键,试题有利于提高学生的分析能力及化学计算能力.

练习册系列答案
相关题目
11.下列说法正确的是( )
| A. | 将FeCl3溶液加热蒸干,可得到FeCl3固体 | |
| B. | 配制FeSO4溶液时,为抑制Fe2+水解,先将FeSO4固体溶于稀硫酸中,然后稀释至所需浓度 | |
| C. | 将PH=9的KOH溶液稀释1000倍后,其PH=6 | |
| D. | 碳酸溶液中氢离子浓度是碳酸根离子浓度的二倍 |
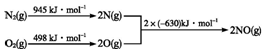
5.在一定温度下,如图1,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图2所示.则下列有关推断正确的是( )

| A. | 该反应的化学方程式为:3X+2Y?2Z | |
| B. | 若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间小于t0 | |
| C. | 若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态 | |
| D. | 若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应 |
9.甲醇是重要的化学工业基础原料和液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如表所示:
(1)反应②是吸热(填“吸热”或“放热”)反应.
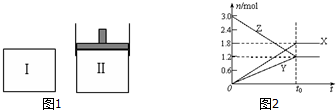
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).
(3)500℃K3=2.5;反应③△H<0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2mol、10mol、10mol,此时v(正)>v(逆) (填“>”“=”或“<”)
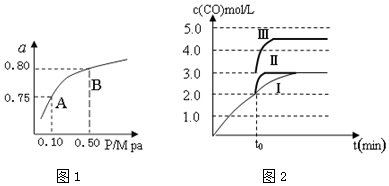
(4)一定温度下,在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积快速压缩至2L.
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O (g) | K3 | ||
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).

(3)500℃K3=2.5;反应③△H<0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2mol、10mol、10mol,此时v(正)>v(逆) (填“>”“=”或“<”)
(4)一定温度下,在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积快速压缩至2L.
6.在测定中和热的实验中,下列说法正确的是( )
| A. | 测量中和热时不能用金属棒搅拌混合溶液 | |
| B. | 中和热不是一个定值,其大小由中和反应所消耗的酸和碱的多少决定 | |
| C. | 50mL0.5mol/LHCl和50mL0.55mol/LNaOH溶液反应测定中和热,计算式为△H=$\frac{4.18×100}{0.025}$×△tKJ/mol (注:△t-温度平均变化量) | |
| D. | 为了减少误差,量取稀NaOH溶液后,立即用同一个量筒量取稀硫酸 |
3.下列实验操作完全正确的是( )
| 实验 | 操作 | |
| A | 用苯萃取碘水中碘后,静置后取出有机层 | 先从分液漏斗下端管口放出下层液体,关闭活塞,换一个接收容器,再继续从分液漏斗下端管口放出上层液体 |
| B | 配制500mL2mol/L的氯化铵溶液 | 用托盘天平称取53.5g氯化铵晶体放入500mL容量瓶,加少量水,振荡后再加水至刻度线 |
| C | 测定氯水的pH | 用玻璃棒蘸取少量溶液滴于pH试纸中央,片刻后与标准比色卡对照 |
| D | 用标准盐酸滴定未知浓度的NaOH溶液(含酚酞) | 左手控制酸式滴定管活塞使液体滴下,右手不断振荡锥形瓶,眼睛要始终观察锥形瓶中溶液颜色变化 |
| A. | A | B. | B | C. | C | D. | D |