题目内容
19.化学在日常生活和生产中有着重要的应用.下列说法不正确的是( )| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为溶液中的SO32- 发生水解 | |
| C. | 将饱和FeCl3溶液滴入沸水中可制备Fe(OH)3胶体,利用的是盐类水解原理 | |
| D. | 纯碱溶液呈碱性的原因是CO3 2-+H2O?HCO3-+OH- |
分析 A.明矾是铝盐,铝离子在水中水解生成氢氧化铝胶体,胶体表面积大,吸附性强;
B.pH由4.68变为4.28,主要是雨水中溶解的二氧化硫生成亚硫酸,亚硫酸被氧化为硫酸;
C.三价铁离子结合水电离出的氢氧根离子,水解是吸热过程,升温促进水解;
D.纯碱是碳酸钠,属于强碱弱酸盐,碳酸根结合水电离出的氢离子,使溶液中的氢氧根浓度大于氢离子浓度,溶液呈碱性.
解答 解:A.明矾净水的原理是:Al3++3H2O=Al(OH)3(胶体)+3H+,利用Al(OH)3(胶体)的吸附性进行净水,故A正确;
B.正常的雨水溶解二氧化碳,其PH为5.6,pH值小于5.6为酸雨,pH由4.68变为4.28,主要是雨水中溶解的二氧化硫生成亚硫酸,亚硫酸被氧化为硫酸,由弱酸转化为强酸,酸性增强,故B错误;
C.三价铁离子结合水电离出的氢氧根离子生成氢氧化铁,水解是吸热过程,升温促进水解且饱和氯化铁浓度较大,有利于胶体的生成,故C正确;
D.纯碱是碳酸钠,属于强碱弱酸盐,碳酸根结合水电离出的氢离子,使溶液中的氢氧根浓度大于氢离子浓度,溶液呈碱性,碳酸根是多元弱酸根,分步水解,第一步水解离子方程式为:CO3 2-+H2O?HCO3-+OH-,故D正确;
故选B.
点评 本题考查较为综合,涉及盐类水解的应用、二氧化硫的污染、酸雨等知识,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生的良好的科学素养,提高学生学习的积极性,难度不大,注意相关基础知识的积累.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
7.下列说法正确的是( )
| A. | 凡有能量变化的过程都是化学变化 | |
| B. | 可逆反应进行的程度是不可改变的 | |
| C. | 化学键的断裂和形成是化学反应能量变化的主要原因 | |
| D. | 能自发进行的化学反应,一定是△H<0、△S>0 |
4.短周期元素X、Y、Z、W、R的原子序数依次增大,Y原子达到稳定结构获得的电子数目和它的内层电子数目相等,X与Z同主族,Z是所在周期主族元素中原子半径最大的元素,W的最外层电子数与电子层数相同,R与Z形成的化合物其水溶液呈碱性.下列说法正确的是( )
| A. | 离子半径由大到小的顺序为R、Z、Y、W | |
| B. | X、Y分别与Z形成的多种化合物中化学键类型相同 | |
| C. | Y、R分别与X形成的化合物沸点依次升高 | |
| D. | Z、W、R最高价氧化物对应的水化物两两之间均能发生反应 |
11.下列说法正确的是( )
| A. | 将FeCl3溶液加热蒸干,可得到FeCl3固体 | |
| B. | 配制FeSO4溶液时,为抑制Fe2+水解,先将FeSO4固体溶于稀硫酸中,然后稀释至所需浓度 | |
| C. | 将PH=9的KOH溶液稀释1000倍后,其PH=6 | |
| D. | 碳酸溶液中氢离子浓度是碳酸根离子浓度的二倍 |
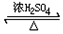 CH3COOC2H5+H2O;该反应的有机反应类型是取代(酯化)反应.
CH3COOC2H5+H2O;该反应的有机反应类型是取代(酯化)反应.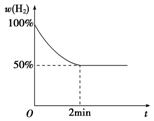 钠是一种非常活泼的金属元素,其单质及化合物在科研、生产中起着重要作用.
钠是一种非常活泼的金属元素,其单质及化合物在科研、生产中起着重要作用.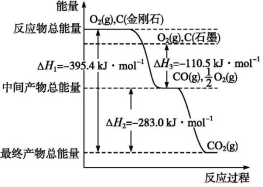 (1)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知:
(1)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知: