题目内容
6.下列有关概念的叙述中正确的是( )| A. | 非金属氧化物一定都是酸性氧化物 | |
| B. | 碱性氧化物一定都是金属氧化物 | |
| C. | 既能与酸反应又能与碱反应的物质一定具有两性 | |
| D. | 氧化还原反应一定都是离子反应 |
分析 A.酸性氧化物不一定是非金属氧化物,可能是金属氧化物;
B.能和酸反应只生成盐和水的氧化物是碱性氧化物;
C.碳酸氢铵、碳酸铵等均与酸、碱反应;
D.有离子参加或生成的反应属于离子反应,存在化合价变化的反应是氧化还原反应.
解答 解:A.酸性氧化物不一定是非金属氧化物,如Mn2O7,是酸性氧化物,但是金属氧化物,故A错误;
B.能和酸反应只生成盐和水的氧化物是碱性氧化物,碱性氧化物肯定是金属氧化物,金属氧化物不一定是碱性氧化物,故B正确;
C.碳酸氢铵、碳酸铵等均与酸、碱反应,碳酸铵显碱性,既能与酸又能与碱反应的物质不一定是两性物质,故C错误;
D.有离子参加或生成的反应属于离子反应,存在化合价变化的反应是氧化还原反应,氧化还原反应不一定都是离子反应,如氢气与氧化铜的反应是氧化还原反应,不是离子反应,故D错误.
故选B.
点评 本题考查氧化还原反应、物质的分类,为高频考点,侧重于基本概念的理解,要求学生能熟练把握物质的性质,答题时能举出实例,难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
16.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如表数据(盐酸的物质的量浓度相同):
则下列分析推理中正确的是( )
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
| A. | 根据表中数据不能计算出混合物中NaHCO3的质量 | |
| B. | 根据表中数据可救出盐酸的物质的量浓度为3mol•L-1 | |
| C. | 加入混合物9.2 g时恰好与盐酸完全反应 | |
| D. | 15.7 g混合物恰好与盐酸完全反应 |
1.下列说法正确的是( )
| A. | 因为Fe3+具有氧化性,所以可以用KSCN溶液检验Fe3+ | |
| B. | 将FeCl3饱和溶液滴入NaOH溶液中可制备Fe(OH)3胶体 | |
| C. | FeCl2溶液蒸干灼烧后得到FeCl2固体 | |
| D. | Fe3O4溶于盐酸后加入几滴KSCN溶液,溶液显红色 |
11.下列说法正确的是( )
| A. | 将FeCl3溶液加热蒸干,可得到FeCl3固体 | |
| B. | 配制FeSO4溶液时,为抑制Fe2+水解,先将FeSO4固体溶于稀硫酸中,然后稀释至所需浓度 | |
| C. | 将PH=9的KOH溶液稀释1000倍后,其PH=6 | |
| D. | 碳酸溶液中氢离子浓度是碳酸根离子浓度的二倍 |
15.生活中处处有化学,化学是人类进步的关键.下列表述错误的是( )
| A. | 低碳生活就是倡导低污染,低消耗,减少温室气体的排放 | |
| B. | 食用醋、医疗酒精、肥皂水三种溶液的pH逐渐增大 | |
| C. | 用活性炭为糖浆脱色和用臭氧漂白纸浆,二者所用原理相同 | |
| D. | 久置的植物油会严生难闻的特殊气味,是由于植物油发生了变质 |
9.甲醇是重要的化学工业基础原料和液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如表所示:
(1)反应②是吸热(填“吸热”或“放热”)反应.
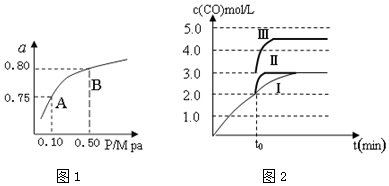
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).
(3)500℃K3=2.5;反应③△H<0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2mol、10mol、10mol,此时v(正)>v(逆) (填“>”“=”或“<”)
(4)一定温度下,在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积快速压缩至2L.
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O (g) | K3 | ||
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).

(3)500℃K3=2.5;反应③△H<0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2mol、10mol、10mol,此时v(正)>v(逆) (填“>”“=”或“<”)
(4)一定温度下,在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积快速压缩至2L.
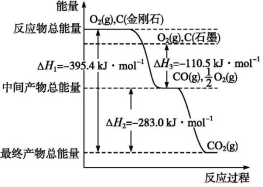 (1)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知:
(1)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知: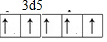 .
.