题目内容
3.下列说法不正确的是( )| A. | 25℃时Kw=1.0×10-14,将稀硫酸加热至90℃(忽略溶液体积变化)其pH不变 | |
| B. | pH与体积都相同的醋酸和硝酸溶液分别用0.1mol•L-1氢氧化钠溶液恰好中和,所需的氢氧化钠溶液体积前者一定大于后者 | |
| C. | 0.2 mol•L-1CH3COONa溶液和0.1mol•L-1盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(Cl-) | |
| D. | 向少量AgNO3溶液中滴加适量NaCl溶液,再滴加适量KI溶液,若开始有白色沉淀生成,后逐渐变为黄色沉淀,即说明Ksp(AgI)<Ksp(AgCl) |
分析 A.pH=-lgc(H+),加热过程中氢离子浓度不变,则溶液的pH不变;
B.醋酸为弱酸,pH相同时醋酸的浓度较大,则中和时消耗NaOH溶液的体积较大;
C.溶液中还存在氢氧根离子,该关系式不满足电荷守恒;
D.开始有白色沉淀生成,后逐渐变为黄色沉淀,实现了沉淀的转化,结合溶度积越小越容易生成沉淀分析.
解答 解:A.25℃时将稀硫酸加热至90℃(忽略溶液体积变化),由于溶液中氢离子浓度不变,则该溶液的pH不变,故A正确;
B.pH与体积都相同的醋酸和硝酸溶液分别用0.1mol•L-1氢氧化钠溶液恰好中和,由于醋酸为弱酸,其浓度大于硝酸,则恰好中和时所需的氢氧化钠溶液体积前者一定大于后者,故B正确;
C.0.2 mol•L-1CH3COONa溶液和0.1mol•L-1盐酸等体积混合所得碱性溶液中,根据电荷守恒可得:c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)+c(OH-),故C错误;
D.向少量AgNO3溶液中滴加适量NaCl溶液,再滴加适量KI溶液,若开始有白色沉淀生成,后逐渐变为黄色沉淀,说明碘化银更难溶,说明碘化银的溶度积较小,即Ksp(AgI)<Ksp(AgCl),故D正确;
故选C.
点评 本题考查较为综合,涉及酸碱混合的定性判断及溶液pH的计算、离子浓度大小比较、难溶物溶度积比较等知识,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,明确难溶物溶解平衡及沉淀转化的实质,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
11.下列说法正确的是( )
| A. | 将FeCl3溶液加热蒸干,可得到FeCl3固体 | |
| B. | 配制FeSO4溶液时,为抑制Fe2+水解,先将FeSO4固体溶于稀硫酸中,然后稀释至所需浓度 | |
| C. | 将PH=9的KOH溶液稀释1000倍后,其PH=6 | |
| D. | 碳酸溶液中氢离子浓度是碳酸根离子浓度的二倍 |
15.生活中处处有化学,化学是人类进步的关键.下列表述错误的是( )
| A. | 低碳生活就是倡导低污染,低消耗,减少温室气体的排放 | |
| B. | 食用醋、医疗酒精、肥皂水三种溶液的pH逐渐增大 | |
| C. | 用活性炭为糖浆脱色和用臭氧漂白纸浆,二者所用原理相同 | |
| D. | 久置的植物油会严生难闻的特殊气味,是由于植物油发生了变质 |
5.在一定温度下,如图1,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图2所示.则下列有关推断正确的是( )
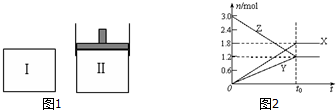

| A. | 该反应的化学方程式为:3X+2Y?2Z | |
| B. | 若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间小于t0 | |
| C. | 若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态 | |
| D. | 若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应 |
6.在测定中和热的实验中,下列说法正确的是( )
| A. | 测量中和热时不能用金属棒搅拌混合溶液 | |
| B. | 中和热不是一个定值,其大小由中和反应所消耗的酸和碱的多少决定 | |
| C. | 50mL0.5mol/LHCl和50mL0.55mol/LNaOH溶液反应测定中和热,计算式为△H=$\frac{4.18×100}{0.025}$×△tKJ/mol (注:△t-温度平均变化量) | |
| D. | 为了减少误差,量取稀NaOH溶液后,立即用同一个量筒量取稀硫酸 |
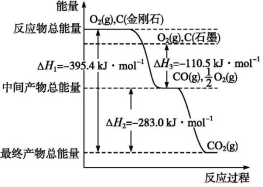 (1)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知:
(1)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知: .
.