题目内容
2.已知:SO32-+I2+H2O→SO42-+2I-+2H+.某溶液中可能含有Na+、NH4+、Fe2+、K+、I-、SO32-、SO42-,且所有离子物质的量浓度相等.向该无色溶液中滴加少量溴水,溶液仍呈无色.下列关于该溶液的判断正确的是( )| A. | 肯定不含I- | B. | 肯定不含SO42- | C. | 肯定不含SO32- | D. | 肯定含有NH4+ |
分析 向该无色溶液中滴加少量溴水,溶液仍呈无色,则一定不含Fe2+,一定含SO32-,结合离子浓度相等、溶液为电中性来解答.
解答 解:Fe2+、I-均与溴水发生氧化还原反应后,溶液具有颜色,由SO32-+I2+H2O═SO42-+2I-+2H+可知,
则向该无色溶液中滴加少量溴水,溶液仍呈无色,则一定不含Fe2+,一定含SO32-,
又离子浓度相等、溶液为电中性,
若阴离子只有SO32-,则含 Na+、NH4+、K+中的两种,
若含SO32-、I-,则含 Na+、NH4+、K+,
若含SO32-、SO42-,不遵循电荷守恒,则一定不存在SO42-,
故选B.
点评 本题考查常见离子的检验,为高频考点,把握氧化的先后顺序、发生的氧化还原反应为解答的关键,侧重分析与实验能力的考查,注意电荷守恒的应用,题目难度不大.

练习册系列答案
相关题目
7.下列说法正确的是( )
| A. | 凡有能量变化的过程都是化学变化 | |
| B. | 可逆反应进行的程度是不可改变的 | |
| C. | 化学键的断裂和形成是化学反应能量变化的主要原因 | |
| D. | 能自发进行的化学反应,一定是△H<0、△S>0 |
11.下列说法正确的是( )
| A. | 将FeCl3溶液加热蒸干,可得到FeCl3固体 | |
| B. | 配制FeSO4溶液时,为抑制Fe2+水解,先将FeSO4固体溶于稀硫酸中,然后稀释至所需浓度 | |
| C. | 将PH=9的KOH溶液稀释1000倍后,其PH=6 | |
| D. | 碳酸溶液中氢离子浓度是碳酸根离子浓度的二倍 |
5.在一定温度下,如图1,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图2所示.则下列有关推断正确的是( )
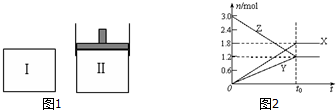

| A. | 该反应的化学方程式为:3X+2Y?2Z | |
| B. | 若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间小于t0 | |
| C. | 若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态 | |
| D. | 若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应 |
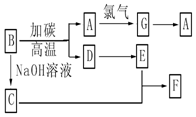 请回答下列问题:
请回答下列问题: 钠是一种非常活泼的金属元素,其单质及化合物在科研、生产中起着重要作用.
钠是一种非常活泼的金属元素,其单质及化合物在科研、生产中起着重要作用.
 (1)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知:
(1)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知: