题目内容
19.常温时,向一定量的硫酸铜溶液中滴加pH=11 的氨水,当Cu2+完全沉淀时,消耗氨水的体积为V,下列说法正确的是(已知Ksp[Cu(OH)2]=2.2×10-20)( )| A. | 若将氨水加水稀释,则稀释过程中,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$始终保持增大 | |
| B. | 滴加过程中,当溶液中c(Cu2+)=2.2×10-2mol/L 时,溶液的pH=9 | |
| C. | 滴加过程中,当溶液的pH=7 时,溶液中2c(NH4+)=c(SO42-) | |
| D. | 若滴加pH=11 的NaOH 溶液,Cu2+完全沉淀时消耗溶液的体积小于V |
分析 A.将氨水加水稀释,促进氨水的电离;
B.根据Ksp[Cu(OH)2]=2.2×10-20计算c(OH-),然后计算溶液的pH;
C.当溶液的pH=7时c(H+)=c(OH-),根据溶液的电荷守恒判断;
D.pH=11的NaOH溶液浓度小于pH=11的氨水.
解答 解:A.稀释氨水,一水合氨按的电离程度增大,溶液中n(NH4+)增大、n(NH3•H2O)减小,则$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$始终保持增大,故A正确;
B.当溶液中c(Cu2+)=2.2×10-2mol/L时,由Ksp[Cu(OH)2]=2.2×10-20可知,c(OH-)=$\sqrt{\frac{2.2×1{0}^{-20}}{2.2×1{0}^{-2}}}$=1×10-9mol/L,此时溶液的pH=5,故B错误;
C.当溶液的pH=7时,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒2c(Cu2+)+c(H+)+c(NH4+)=2c(SO42-)+c(OH-)可知:2c(Cu2+)+c(NH4+)=2c(SO4 2-),故C错误;
D.氨水为弱电解质的水溶液,pH=11的Na0H溶液浓度小于pH=11的氨水,若滴加pH=11的Na0H溶液,Cu2+完全沉淀时消耗溶液的体积大于V,故D错误;
故选A.
点评 本题综合考查难溶电解质的溶解平衡及弱电解质的电离,为高频考点,题目难度中等,注意掌握难溶物溶解平衡及其影响,明确弱电解质电离平衡特点,试题侧重于学生的分析、计算能力的考查.

练习册系列答案
相关题目
9.下列关于有机化合物的说法正确的是( )
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | 化合物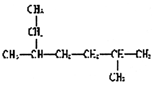 的名称为2-甲基-5-乙基己烷 的名称为2-甲基-5-乙基己烷 | |
| C. | 纤维素和油脂都是能发生水解反应的高分子化合物 | |
| D. | 甲烷、苯、乙醇、乙酸和酯类都可以发生取代反应 |
10.下列反应属于置换反应的是( )
| A. | Fe+CuSO4═FeSO4+Cu | B. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ | ||
| C. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 | D. | NaOH+HCl═NaCl+H2O |
14.下列变化过程不涉及化学反应的是( )
| A. | 陶瓷的烧制 | B. | 活字印刷排版术 | ||
| C. | 鞭炮和烟花的燃放 | D. | 司母戊鼎表面出现铜绿 |
4.化学与人类生产、生活、社会可持续发展密切相关,下列说法正确的是( )
| A. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| B. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| C. | 人体缺乏铁元素,可以补充硫酸亚铁,且多多益善 | |
| D. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 |
11.化学在生产、生活中有广泛应用,下列对应关系正确的是( )
| 化学性质 | 实际应用 | |
| A | SO2具有还原性 | 用SO2漂白纸浆 |
| D | Fe3+具有氧化姓 | 硫酸铁可用作净水剂 |
| C | 维生素C易被氧气氧化 | 用作食品抗氧化剂 |
| D | H2O2受热或光照易分解 | 双氧水用作医疗上的消毒剂 |
| A. | A | B. | B | C. | C | D. | D |
8.下列过程不涉及氧化还原反应的是( )
| A. | 大气固氮 | B. | 工业制漂粉精 | ||
| C. | 用SO2漂白纸浆 | D. | 天宫一号中用Na2O2供氧 |
7.在标准状况下,将A气体V L (摩尔质量是M g•mol-1)溶于0.5L水中,所得溶液的密度为a g•cm-3,则此溶液的物质的量浓度为( )
| A. | $\frac{1000Va}{MV+1120}$ mol•L -1 | B. | $\frac{1000Va}{MV+22400}$ mol•L -1 | ||
| C. | $\frac{1000Va}{MV+11200}$ mol•L -1 | D. | $\frac{1000V•M}{2240(V+0.5)a}$ mol•L -1 |

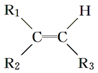 $\stackrel{氧化}{→}$
$\stackrel{氧化}{→}$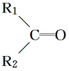 +R3COOH
+R3COOH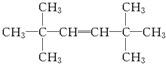 G:
G: .
.