题目内容
10.下列反应属于置换反应的是( )| A. | Fe+CuSO4═FeSO4+Cu | B. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ | ||
| C. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 | D. | NaOH+HCl═NaCl+H2O |
分析 单质与化合物反应生成新单质、化合物的反应,为置换反应,以此来解答.
解答 解:A.Fe+CuSO4═FeSO4+Cu为置换反应,故A选;
B.2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑为分解反应,故B不选;
C.S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2为化合反应,故C不选;
D.NaOH+HCl═NaCl+H2O为复分解反应,故D不选;
故选A.
点评 本题考查四种基本反应类型,为高频考点,把握物质的类别、基本反应类型的判断为解答的关键,侧重分析与应用能力的考查,注意化学反应的分类法,题目难度不大.

练习册系列答案
相关题目
1.下列反应属于氧化还原反应,且能量变化如图所示的是( )
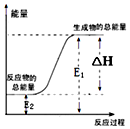

| A. | 锌粒和稀硫酸反应 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 甲烷在空气中燃烧的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
18.下列除杂方法错误的是( )
| 括号内为杂质 | 实验操作或方法 | |
| A | NO2(NO) | 通入O2 |
| B | CuSO4溶液(硫酸铁) | 加入足量CuO,过滤 |
| C | 溴苯(溴) | 加入NaOH溶液,分液 |
| D | MnO2(I2) | 加热 |
| A. | A | B. | B | C. | C | D. | D |
5.电离平衡是溶液化学中的重要内容,某化学兴趣小组拟以乙酸为例探究弱酸的性质.
(1)实验一:氢氧化钠标准溶液的配制.
现要配制0.1000mol/LNaOH标准溶液250mL,需要用到的玻璃仪器有玻璃棒、烧杯、胶头滴管和250毫升容量瓶,操作过程中如果没有将烧杯等的洗涤液一并转入容量瓶,在其它操作都正确的情况下,将该标准溶液用来滴定下列(2)中的未知浓度的乙酸溶液,将会使侧定的结果偏高(填“高”、“低”、“不影响”)
(2)实验二:现有一瓶乙酸溶液,常温下测定其中乙酸的电离平衡常数.设计实验方案,将待测物理量和对应的测定方法填写在表一中.
表一:
③上述实验中,如果在某温度时测得乙酸溶液的物质的量浓度为0.1000mol/L,pH=3,则在该温度时乙酸的电离平衡常数为1×10-5.
(3)实验三:探究酸的强弱对酸与镁条反应速率的影响.
①设计实验方案如表二,表二中c=2.0g.
表二:
②实验步骤:
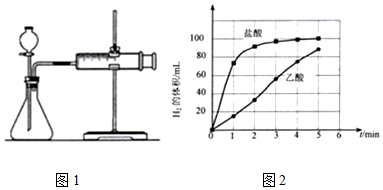
a)图1的装置中,在添加药品之前必须检查装置的气密性;
b)反应开始后,每隔1min记录一次生成H2的体积;
c)将所记录的欲据绘制成曲线图(图2).
③写出镁与乙酸溶液反应的离子方程式:Mg+2CH3COOH=Mg2++2CH3COO-+H2↑.
④描述0~5min盐酸与镁条反应的反应速率变化规律:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小.
(1)实验一:氢氧化钠标准溶液的配制.
现要配制0.1000mol/LNaOH标准溶液250mL,需要用到的玻璃仪器有玻璃棒、烧杯、胶头滴管和250毫升容量瓶,操作过程中如果没有将烧杯等的洗涤液一并转入容量瓶,在其它操作都正确的情况下,将该标准溶液用来滴定下列(2)中的未知浓度的乙酸溶液,将会使侧定的结果偏高(填“高”、“低”、“不影响”)
(2)实验二:现有一瓶乙酸溶液,常温下测定其中乙酸的电离平衡常数.设计实验方案,将待测物理量和对应的测定方法填写在表一中.
表一:
| 待测物理量 | 测定方法 |
| ①乙酸溶液的物质的量浓度 | 量取25.00mL乙酸溶液于锥形瓶中,滴加指示剂,将0.1000mol/LNaOH标准溶液装入碱式滴定管,滴定至终点,记录数据.重复滴定2次. |
| ②H+的物质的量浓度 | 取适最乙酸溶液于烧杯中,用pH计或精密pH试纸测定溶液pH. |
(3)实验三:探究酸的强弱对酸与镁条反应速率的影响.
①设计实验方案如表二,表二中c=2.0g.
表二:
| 编号 | 酸的种类 | 酸的浓度(mol/L) | 酸的体积/mL | 镁条质量/g |
| l | 乙酸 | 0.5 | 17.0 | 2.0 |
| 2 | 盐酸 | 0.5 | 17.0 | c |

a)图1的装置中,在添加药品之前必须检查装置的气密性;
b)反应开始后,每隔1min记录一次生成H2的体积;
c)将所记录的欲据绘制成曲线图(图2).
③写出镁与乙酸溶液反应的离子方程式:Mg+2CH3COOH=Mg2++2CH3COO-+H2↑.
④描述0~5min盐酸与镁条反应的反应速率变化规律:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小.
15.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温下,10g46%的CH3CH2OH溶液中所含有的氧原子数为0.4NA | |
| B. | 向FeI2溶液中通人适量的Cl2,当有1molFe2+被氧化时,共转移电子数目为3NA | |
| C. | 在标准状况下,将11.2LHCl溶于1L水中,溶液中HCl分子数为0.5NA | |
| D. | 常温常压下,0.1molNaHSO4晶体中,含有阴阳离子数共0.3NA |
19.常温时,向一定量的硫酸铜溶液中滴加pH=11 的氨水,当Cu2+完全沉淀时,消耗氨水的体积为V,下列说法正确的是(已知Ksp[Cu(OH)2]=2.2×10-20)( )
| A. | 若将氨水加水稀释,则稀释过程中,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$始终保持增大 | |
| B. | 滴加过程中,当溶液中c(Cu2+)=2.2×10-2mol/L 时,溶液的pH=9 | |
| C. | 滴加过程中,当溶液的pH=7 时,溶液中2c(NH4+)=c(SO42-) | |
| D. | 若滴加pH=11 的NaOH 溶液,Cu2+完全沉淀时消耗溶液的体积小于V |
20.设NA为阿伏加德罗常数的值,下列说怯正确的是( )
| A. | 88.0gCO2与N2O的混合物中所含中子数为44NA | |
| B. | 0.1L1.0mol•L-1的NaAlO2水溶液中含有的氧原子数等于0.2NA | |
| C. | 100mL12mol•的浓HNO3与过量的Cu反应转移电子的数目为0.6NA | |
| D. | 46g乙醇中存在的共价键总数为7NA |
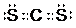 ,该分子为非极性(选填“极性”、“非极性”)分子.
,该分子为非极性(选填“极性”、“非极性”)分子.