题目内容
11.化学在生产、生活中有广泛应用,下列对应关系正确的是( )| 化学性质 | 实际应用 | |
| A | SO2具有还原性 | 用SO2漂白纸浆 |
| D | Fe3+具有氧化姓 | 硫酸铁可用作净水剂 |
| C | 维生素C易被氧气氧化 | 用作食品抗氧化剂 |
| D | H2O2受热或光照易分解 | 双氧水用作医疗上的消毒剂 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.漂白性用于漂白纸浆;
B.Fe3+水解生成胶体具有吸附性;
C.维生素C具有还原性;
D.利用强氧化性杀菌消毒.
解答 解:A.漂白性用于漂白纸浆,与二氧化硫的漂白性有关,与还原性无关,故A错误;
B.Fe3+水解生成胶体具有吸附性,硫酸铁可用作净水剂,与铁离子的氧化性无关,故B错误;
C.维生素C具有还原性,则用作食品抗氧化剂,故C正确;
D.双氧水用作医疗上的消毒剂,与其强氧化性有关,与是否分解无关,故D错误;
故选C.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应、性质与用途为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列反应属于氧化还原反应,且能量变化如图所示的是( )
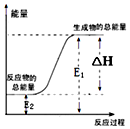

| A. | 锌粒和稀硫酸反应 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 甲烷在空气中燃烧的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
19.常温时,向一定量的硫酸铜溶液中滴加pH=11 的氨水,当Cu2+完全沉淀时,消耗氨水的体积为V,下列说法正确的是(已知Ksp[Cu(OH)2]=2.2×10-20)( )
| A. | 若将氨水加水稀释,则稀释过程中,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$始终保持增大 | |
| B. | 滴加过程中,当溶液中c(Cu2+)=2.2×10-2mol/L 时,溶液的pH=9 | |
| C. | 滴加过程中,当溶液的pH=7 时,溶液中2c(NH4+)=c(SO42-) | |
| D. | 若滴加pH=11 的NaOH 溶液,Cu2+完全沉淀时消耗溶液的体积小于V |
6.生活处处有化学,下列说法不正确的是( )
| A. | 明矾可作净水剂 | |
| B. | 生石灰用于食品抗氧化剂 | |
| C. | 用热碱水清除炊具上残留的油污 | |
| D. | 用浸泡过高锰酸钾溶液的硅藻土保存水果 |
16.有关化学键和晶体的说法正确的是( )
| A. | 两种元素组成的晶体一定只含极性键 | |
| B. | 离子晶体一定不含非极性键 | |
| C. | 原子晶体一定含有共价键 | |
| D. | 分子晶体一定含有共价键 |
3.1mol H2分子和1mol N2分子一定具有相同的( )
| A. | 电子数 | B. | 原子数 | C. | 质子数 | D. | 体积 |
20.设NA为阿伏加德罗常数的值,下列说怯正确的是( )
| A. | 88.0gCO2与N2O的混合物中所含中子数为44NA | |
| B. | 0.1L1.0mol•L-1的NaAlO2水溶液中含有的氧原子数等于0.2NA | |
| C. | 100mL12mol•的浓HNO3与过量的Cu反应转移电子的数目为0.6NA | |
| D. | 46g乙醇中存在的共价键总数为7NA |
19.下列指定反应的离子方程式正确的是( )
| A. | 用过量氨水吸收工业尾气中的SO2:NH3•H2O+SO2═NH4++HSO3- | |
| B. | Ba(HCO3)2溶液中加入稀硫酸:Ba2++HCO3-+H++SO42-═BaSO4↓+CO2↑+H2O | |
| C. | FeCl2溶液中滴加过量溴水:2Fe2++Br2═2Fe3++2Br- | |
| D. | 用铜电极电解NaCl溶液:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- |