题目内容
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 46g的NO2和N2O4混合气体含有的原子数为3NA | |
| B. | 22.4L的Cl2与足量Fe反应,转移的电子数为3NA | |
| C. | 50mL 18mol•L-1浓硫酸与足量Cu共热,转移的电子数为0.9MA | |
| D. | 高温下,0.3molFe与足量水蒸气反应,生成H2的分子数为0.3NA |
分析 A、NO2和N2O4的最简式均为NO2;
B、氯气所处的状态不明确;
C、铜只能与浓硫酸反应,与稀硫酸不反应;
D、铁与水蒸气反应时,3mol铁生成4mol氢气.
解答 解:A、NO2和N2O4的最简式均为NO2,故46g混合物中含有的NO2的物质的量为n=$\frac{46g}{46g/mol}$=1mol,则含有3mol原子即3NA个,故A正确;
B、氯气所处的状态不明确,故其物质的量不能计算,则与铁反应后转移的电子数无法计算,故B错误;
C、铜只能与浓硫酸反应,与稀硫酸不反应,故浓硫酸不能反应完全,则转移的电子数小于0.9NA个,故C错误;
D、铁与水蒸气反应时,3mol铁生成4mol氢气,故0.3mol铁生成0.4mol氢气即0.4NA个氢气分子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
15.下列变化属于物理变化的是( )
| A. | 液氨致冷 | B. | 电解制铝 | C. | 钙基固硫 | D. | 高炉炼铁 |
16.2015年10月,中国科学家屠呦呦获得诺贝尔生理学或医学奖,理由是她发现了青嵩素,并用青嵩素两步合成得到青嵩琥酯,这种药品可以有效降低疟疾患者的死亡率.下列有关说法正确的是( )


| A. | 青嵩素分子式为C15H23O5 | B. | 青嵩素不能与NaOH溶液反应 | ||
| C. | 反应②原子利用率为100% | D. | 青嵩琥不能与碳酸氢钠溶液反应 |
13.用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸反应的产物,下列有关说法正确的是( )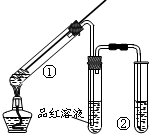

| A. | 品红溶液的作用是吸收SO2,防止污染空气 | |
| B. | 试管②中盛放的试剂通常是NaOH溶液 | |
| C. | 试管①中有白色固体生成,向①中加水后溶液呈蓝色 | |
| D. | 该反应中浓硫酸既表现了强氧化性,又表现了酸性 |
20.下列关于氧化还原反应的叙述正确的是( )
| A. | 氧化还原反应中,非金属单质一定被还原 | |
| B. | 由H2O2→O2的过程一定需加入氧化剂才能实现 | |
| C. | 置换反应都属于氧化还原反应,反应物中的单质一定作还原剂 | |
| D. | 金属阳离子被还原不一定得到金属单质 |
17.下列物质中,既能发生反应既能使溴水褪色,又能使KMnO4酸性溶液褪色的是( )
| A. |  | B. |  | C. |  | D. | CH3CH2OH |
 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大(填越大、越小),K值大小与温度的关系是:温度升高,K值可能增大也可能减小.(填一定增大、一定减小、或可能增大也可能减小);
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大(填越大、越小),K值大小与温度的关系是:温度升高,K值可能增大也可能减小.(填一定增大、一定减小、或可能增大也可能减小);