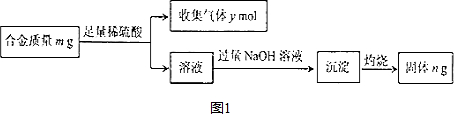
题目内容
20.下列关于氧化还原反应的叙述正确的是( )| A. | 氧化还原反应中,非金属单质一定被还原 | |
| B. | 由H2O2→O2的过程一定需加入氧化剂才能实现 | |
| C. | 置换反应都属于氧化还原反应,反应物中的单质一定作还原剂 | |
| D. | 金属阳离子被还原不一定得到金属单质 |
分析 从化合价变化的角度分析氧化还原反应,在化学反应中,氧化剂得电子被还原,还原剂得电子被氧化,结合物质的性质判断,能举出一些反例.
解答 解:A.氧化还原反应中,如Cl2+H2O=HCl+HClO,非金属既可被氧化,也可被还原,故A错误;
B.由H2O2→O2的过程,可能H2O2即是氧化剂又是还原剂,如H2O2的分解反应,故B错误;
C.非金属单质之间可能发生置换反应,如氯气与NaBr溶液反应生成单质溴,反应中非金属单质氯气作氧化剂,故C错误;
D.金属阳离子被还原不一定得到金属单质,如铁离子被还原得到亚铁离子,故D正确.
故选D.
点评 本题考查氧化还原反应,题目难度不大,注意从化合价的角度判断氧化还原反应的有关概念.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下列有关有机反应的叙述正确的是( )
| A. | 溴乙烷在浓硫酸加热条件下可制得乙烯 | |
| B. | 一定条件下,所有的醇均能发生脱水反应形式碳碳双键或碳碳叁键 | |
| C. | 石油的裂化、裂解,煤的气化、液化都是化学变化 | |
| D. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
8.升高温度,下列数据不一定增大的是( )
| A. | 化学反应速率 | B. | 化学平衡常数 | ||
| C. | 弱电解质的电离常数 | D. | 反应的活化分子百分数 |
15.下列说法错误的是( )
| A. | 硅是良好的半导体材料 | |
| B. | 氨气与硝酸合成氮肥属于人工固氮 | |
| C. | 金刚石、石墨和富勒烯互为同素异形体 | |
| D. | 硬铝、青铜和不锈钢都属于合金 |
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 46g的NO2和N2O4混合气体含有的原子数为3NA | |
| B. | 22.4L的Cl2与足量Fe反应,转移的电子数为3NA | |
| C. | 50mL 18mol•L-1浓硫酸与足量Cu共热,转移的电子数为0.9MA | |
| D. | 高温下,0.3molFe与足量水蒸气反应,生成H2的分子数为0.3NA |
20.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
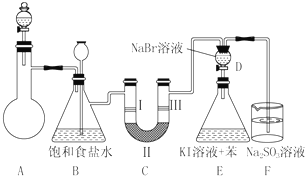
(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关反应的化学方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是d(填编号).
装置B是安全瓶,监测实验进行时C中是否发生堵塞,写出发生堵塞时B中的现象锥形瓶中液面下降,长颈漏斗中液面上升.
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性.反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是E中溶液分为两层,上层(苯层)为紫红色.该现象不能(填“能”或“不能”)说明Br2的氧化性强于I2.
(4)有人提出,装置F中可改用过量的NaHSO3溶液吸收余氯,试写出相应反应的离子方程式4HSO3-+Cl2=SO42-+2Cl-+3SO2↑+2H2O;你认为不能(填“能”或“不能”)改用NaHSO3溶液.

(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关反应的化学方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是d(填编号).
| 编号 | a | b | c | d |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性.反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是E中溶液分为两层,上层(苯层)为紫红色.该现象不能(填“能”或“不能”)说明Br2的氧化性强于I2.
(4)有人提出,装置F中可改用过量的NaHSO3溶液吸收余氯,试写出相应反应的离子方程式4HSO3-+Cl2=SO42-+2Cl-+3SO2↑+2H2O;你认为不能(填“能”或“不能”)改用NaHSO3溶液.