题目内容
13.用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸反应的产物,下列有关说法正确的是( )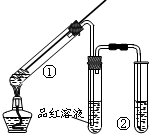
| A. | 品红溶液的作用是吸收SO2,防止污染空气 | |
| B. | 试管②中盛放的试剂通常是NaOH溶液 | |
| C. | 试管①中有白色固体生成,向①中加水后溶液呈蓝色 | |
| D. | 该反应中浓硫酸既表现了强氧化性,又表现了酸性 |
分析 由图可知,①中Cu与浓硫酸发生Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,品红检验二氧化硫,最后的试管中应为NaOH溶液,吸收尾气,以此来解答.
解答 解:A.品红溶液的作用是检验SO2,故A错误;
B.试管②中盛放的试剂通常是NaOH溶液,作用是吸收SO2,防止污染空气,故B正确;
C.试管①中有生成硫酸铜,溶液呈蓝色,故C错误;
D.生成硫酸铜体现硫酸的酸性,生成二氧化硫体现硫酸的氧化性,故D正确;
故选BD.
点评 本题考查化学实验评价及物质的性质,为高频考点,把握实验装置的作用、反应原理、物质的性质为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
3.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | 使酚酞呈红色的溶液:K+、Na+、NO3-、Cl- | |
| C. | 由水电离出的c(H+)=1×10-10mol•L-1的溶液:Mg2+、NH4+、SO42-、HCO3- | |
| D. | 0.1mol•L-1FeCl3溶液:Fe2+、SO42-、NH4+、SCN- |
4.对于反应A(g)+3B(g)?2C(g),下列各数据表示不同条件下的反应速度,其中反应进行得最快的是( )
| A. | v(A)=0.01mol•L-1•s-1 | B. | v(B)=0.02mol•L-1•s-1 | ||
| C. | v(B)=0.60mol•L-1•min-1 | D. | v(C)=1.00mol•L-1•min-1 |
8.升高温度,下列数据不一定增大的是( )
| A. | 化学反应速率 | B. | 化学平衡常数 | ||
| C. | 弱电解质的电离常数 | D. | 反应的活化分子百分数 |
18.下列试剂不会因为空气中的氧气而变质的是( )
| A. | 亚硫酸钠 | B. | 过氧化钠 | C. | 硫酸亚铁 | D. | 氢硫酸 |
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 46g的NO2和N2O4混合气体含有的原子数为3NA | |
| B. | 22.4L的Cl2与足量Fe反应,转移的电子数为3NA | |
| C. | 50mL 18mol•L-1浓硫酸与足量Cu共热,转移的电子数为0.9MA | |
| D. | 高温下,0.3molFe与足量水蒸气反应,生成H2的分子数为0.3NA |
2.某同学拟设计如下流程测定铜银合金中铜的质量分数:
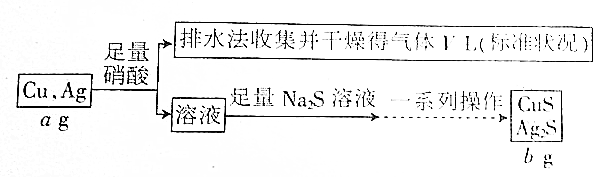
下列说法不正确的是( )

下列说法不正确的是( )
| A. | V L气体是NO | |
| B. | 一系列操作指“过滤、洗涤、烘干” | |
| C. | 上述数据之间的关系有b=$\frac{7a+15v}{7}$ | |
| D. | 根据上述数据能计算合金中铜的质量分数 |
13. 用铅蓄电池电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )
用铅蓄电池电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )
 用铅蓄电池电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )
用铅蓄电池电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( )| A. | 铅蓄电池负极的反应式为:Pb-2e -→Pb2+ | |
| B. | 铅蓄电池放电时,该电池两极质量均减少 | |
| C. | 铅蓄电池充电时,B极应与外电源负极相连 | |
| D. | 电解苦卤水时,a电极首先放电的是Br- |
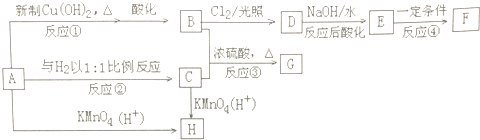
 ,H
,H .
. ;
; .
.
 、
、 .
. )是一种化工产品.请结合题目中有关信息,设计以苯乙烯(
)是一种化工产品.请结合题目中有关信息,设计以苯乙烯(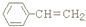 )为原料,制备苯羟乙酸的合成路线(用流程图表示,无机试剂任选).
)为原料,制备苯羟乙酸的合成路线(用流程图表示,无机试剂任选).