题目内容
20.用NA表示阿伏加德罗常数的值.下列叙述不正确的是( )| A. | 25℃时,pH=13的氨水和NaOH溶液各1.0 L含有的OH-数目均为0.1NA | |
| B. | 常温常压下,由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| C. | 22 gD218O分子中,含有质子数和中子数分别为10NA和12NA | |
| D. | 标准状况下,22.4 L CCl4中含有的C-Cl键数目为4NA |
分析 A.25℃时,pH=13的氨水和NaOH溶液中C(OH-)=0.1mol/L;
B.1个二氧化碳分子、1个氧气分子都含有2个氧原子;
C.D218O分子中质量数为2×2+18=22,质子数为10,中子数为1×2+10=12;
D.气体摩尔体积使用对象为气体;
解答 解:A.25℃时,pH=13的氨水和NaOH溶液中C(OH-)=0.1mol/L,则1.0 L含有的OH-数目0.1 mol•L-1×1.0 L=0.1 mol,个数均为0.1NA,故A正确;
B.1个二氧化碳分子、1个氧气分子都含有2个氧原子,则由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA,故B正确;
C.D218O分子中质量数为2×2+18=22,质子数为10,中子数为1×2+10=12.因此22 gD218O分子中含有质子数为10NA,中子数为12NA,故C正确;
D.标准状况下,四氯化碳为液体,不能使用气体摩尔体积,故D错误;
故选:D.
点评 本题考查阿伏伽德罗常数,物质的量的有关计算,注意使用气体摩尔体积时标准状况下的要求及物质所处的状态,题目难度不大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案
相关题目
10.化学与生产、生活密切相关,下列对有关现象及事实的解释正确的是( )
| 现象或事实 | 主要原因 | |
| A | 燃煤中添加适量CaO可减少SO2排放量 | 燃烧中硫元素转化为CaSO3 |
| B | 聚氯乙烯薄膜不能用于包装食品 | 会造成白色污染 |
| C | 夏天雷雨过后感觉到空气特别的清新 | 空气中O3含量增加、尘埃减少 |
| D | 蒸熟的糯米在适当条件可转化为香甜可口的甜酒 | 部分淀粉水解生成葡萄糖与乙醇 |
| A. | A | B. | B | C. | C | D. | D |
11.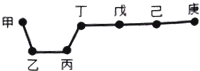 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )| A. | 甲与己形成的化合物一定是离子化合物 | |
| B. | 简单气态氢化物的稳定性:庚>己>戊 | |
| C. | 乙、丙、丁的最高价氧化物水化物可以相互反应 | |
| D. | 庚的最高价氧化物水化物酸性最强 |
8.用如图装置实验,下列实验现象预期及相应结论均正确的是( )
| 选项 | a | b | 实验现象预期 | 结论 | 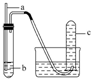 |
| A | 铜丝 | 稀硝酸 | 试管c中有大量红棕色气体 | 硝酸有强氧化性 | |
| B | 木条 | 18.4mol•L-1 硫酸 | 木条变黑 | 浓硫酸有酸性及氧化性 | |
| C | 生铁 | 醋酸溶液 | c中有大量无色气体 | 生铁发生析氢腐蚀 | |
| D | 铁丝 | 含少量HCl的H2O2溶液 | 试管c中有大量无色气体 | 该反应中铁作催化剂 |
| A. | A | B. | B | C. | C | D. | D |
15.分子中均含18个电子的甲、乙、丙、丁4种化合物,含有2种或3种元素,其中甲常温下为气态氢化物,乙常温下为液态氢化物,且相对分子质量和甲相同.下列推断不合理的是( )
| A. | 某钠盐溶液含甲电离出的阴离子,则该溶液显碱性 | |
| B. | 乙中含有化合价为-1的元素 | |
| C. | 丙与氧气的摩尔质量相同,则丙可以是CH3OH | |
| D. | 若丁中含有2种元素且含有ⅣA族元素,则相同条件下丁比甲稳定 |
5.新型可控电池--锂水电池,工作原理如图所示.下列有关说法不正确的是( )
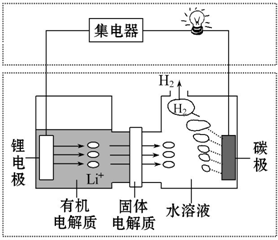

| A. | 碳极发生的反应:2H2O+2e-═H2↑+2OH- | |
| B. | 有机电解质和水溶液不可以互换区域 | |
| C. | 理论上外电路中每转移1 mol电子,负极消耗的质量为7 g | |
| D. | 若该电池可以充电,充电时碳极接外加电源的负极,锂极接外加电源的正极 |
12.运用化学知识,判断下列与安全有关的问题,其中不正确的是( )
| A. | 氢气与氯气应分别贮存在钢瓶中,并放在同一安全室集中保存 | |
| B. | 电石、Na2O2着火时,不能用常规的水枪灭火 | |
| C. | 可燃性颗粒(如面粉,漆粉)弥漫到空气中,可能会引起爆炸 | |
| D. | 油锅着火可用金属锅盖盖灭 |
 .
. .
.