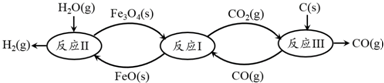
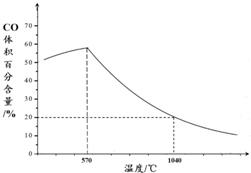
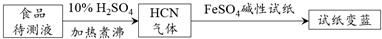
题目内容
3.铋的化合物常用于医学,铋也常与铅、锡、镉、锑、铟等组成一系列低熔合金,可作防火装置、电器保险丝、锅炉和空压机气缸的安全塞等.请回答下列问题:(1)铋是氮的同族元素,比氮多4个电子层,铋在元素周期表中的位置为第6周期第ⅤA族,铋酸的酸性比磷酸的酸性弱(填“强”或“弱”).
(2)已知铋价态为+3价时较稳定,铋酸钠(NaBiO3难电离)在酸性条件下可以将Mn2+氧化成MnO4-,反应的离子方程式为5NaBiO3+2Mn2++14H+=2MnO4-+5Bi3++5Na++7H2O,若有0.1mol氧化产物生成,则转移0.5mol电子.
(3)实验室能否用盐酸酸化铋酸钠溶液不能(填“能”或“不能”),若不能请说明理由HCl中Cl为-1价,是最低化合价,具有还原性,能被铋酸钠在酸性条件下氧化(若能,此问题不用作答).
(4)BiCl3易水解生成BiOCl白色沉淀,则BiCl3溶液的pH是小于7(填“小于”“大于”或“等于”);请写出BiCl3水解的化学方程式BiCl3+H2O?BiOCl↓+2HCl.
(5)医药上把BiOCl叫做次氯酸铋,你同意此名称吗?不同意,说出你的理由:BiOCl中Cl呈-1价,而次氯酸盐中Cl为+1价.
(6)实验室如何配制BiCl3溶液?先用少量盐酸溶解,然后再稀释到相应的浓度.
分析 (1)氮在元素周期表中的位置是第2周期第ⅤA族,铋与N同主族,周期相差4;由于同主族元素随着核电荷数的逐渐增大,元素的非金属性逐渐减弱,对应最高价含氧酸的酸性强;
(2)NaBiO3难电离,被还原为+3价铋时的离子方程式为5NaBiO3+2Mn2++14H+=2MnO4-+5Bi3++5Na++7H2O,氧化产物是MnO4-,结合Mn元素的化合价变化计算转移电子;
(3)因HCl中Cl的化合价为-1价,具有还原性,能被铋酸钠在酸性条件下氧化;
(4)BiCl3易水解,水解方程式为BiCl3+H2O?BiOCl↓+2HCl;
(5)BiOCl中Cl呈-1价,而次氯酸盐中Cl为+1价;
(6)为防止BiCl3水解,应先用少量盐酸溶解抑制水解.
解答 解:(1)氮在元素周期表中的位置是第2周期第ⅤA族,所以铋在元素周期表中的位置为第6周期第ⅤA族;由于同主族元素随着核电荷数的逐渐增大,元素的非金属性逐渐减弱,所以铋酸的酸性比磷酸的酸性要弱,
故答案为:6;VA;弱;
(2)NaBiO3难电离,被还原为+3价铋时的离子方程式为5NaBiO3+2Mn2++14H+=2MnO4-+5Bi3++5Na++7H2O,氧化产物是MnO4-,Mn元素的化合价由+2价升高为+7价,当有0.1 mol氧化产物生成时,转移0.5 mol电子,
故答案为:5NaBiO3+2Mn2++14H+=2MnO4-+5Bi3++5Na++7H2O;0.5;
(3)因HCl中Cl的化合价为-1价,是最低化合价,具有还原性,能被铋酸钠在酸性条件下氧化,因此盐酸不能用于酸化铋酸钠溶液;,
故答案为:不能;HCl中Cl为-1价,是最低化合价,具有还原性,能被铋酸钠在酸性条件下氧化;
(4)BiCl3易水解,水解方程式为BiCl3+H2O?BiOCl↓+2HCl,溶液的pH小于7,
故答案为:小于;BiCl3+H2O?BiOCl↓+2HCl;
(5)BiOCl中Cl呈-1价,而次氯酸盐中Cl为+1价,则不同意,因Cl元素的化合价不同,故答案为:不同意;BiOCl中Cl呈-1价,而次氯酸盐中Cl为+1价;
(6)为防止BiCl3水解,配制BiCl3溶液时应先用少量盐酸溶解,然后再稀释到相应的浓度,故答案为:先用少量盐酸溶解,然后再稀释到相应的浓度.
点评 本题考查金属及化合物的性质,为高频考点,把握氧化还原反应、盐类水解为解答的关键,侧重分析与应用能力的考查,注重元素化合物与反应原理相结合的训练,题目难度不大.

| A. | 二甲苯 | B. | 丁醇 | C. | 一氯丁烯 | D. | 二氯丙烷 |
| A. | C20H30O2、C22H30O2 | B. | C22H32O2、C20H30O2 | ||
| C. | C22H30O2、C20H30O2 | D. | C20H30O2、C22H32O2 |
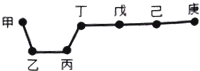 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )| A. | 甲与己形成的化合物一定是离子化合物 | |
| B. | 简单气态氢化物的稳定性:庚>己>戊 | |
| C. | 乙、丙、丁的最高价氧化物水化物可以相互反应 | |
| D. | 庚的最高价氧化物水化物酸性最强 |
| 选项 | a | b | 实验现象预期 | 结论 | 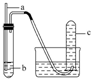 |
| A | 铜丝 | 稀硝酸 | 试管c中有大量红棕色气体 | 硝酸有强氧化性 | |
| B | 木条 | 18.4mol•L-1 硫酸 | 木条变黑 | 浓硫酸有酸性及氧化性 | |
| C | 生铁 | 醋酸溶液 | c中有大量无色气体 | 生铁发生析氢腐蚀 | |
| D | 铁丝 | 含少量HCl的H2O2溶液 | 试管c中有大量无色气体 | 该反应中铁作催化剂 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 某钠盐溶液含甲电离出的阴离子,则该溶液显碱性 | |
| B. | 乙中含有化合价为-1的元素 | |
| C. | 丙与氧气的摩尔质量相同,则丙可以是CH3OH | |
| D. | 若丁中含有2种元素且含有ⅣA族元素,则相同条件下丁比甲稳定 |
| A. | 氢气与氯气应分别贮存在钢瓶中,并放在同一安全室集中保存 | |
| B. | 电石、Na2O2着火时,不能用常规的水枪灭火 | |
| C. | 可燃性颗粒(如面粉,漆粉)弥漫到空气中,可能会引起爆炸 | |
| D. | 油锅着火可用金属锅盖盖灭 |
| A. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 | |
| B. | 含乙醇、NaClO、H2O2等消毒液均可以将病毒氧化而达到消毒目的 | |
| C. | 有机玻璃受热软化,易于加工成型,是一种硅酸盐材料 | |
| D. | 处理废水时,加入明矾作为消毒剂除去水中的细菌 |