题目内容
10.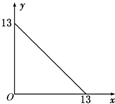 某温度(t℃)下的溶液中,[H+]=10-xmol•L-1,[OH-]=10-y mol•L-1,x与y的关系如图所示,请回答下列问题:
某温度(t℃)下的溶液中,[H+]=10-xmol•L-1,[OH-]=10-y mol•L-1,x与y的关系如图所示,请回答下列问题:(1)此温度下,水的离子积KW为10-13 mol2•L-2,则该温度t>25℃(填“>”“<”或“=”),pH=7的溶液显碱(填“酸”“碱”或“中”)性.
(2)若将此温度(t℃)下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(假设混合后溶液体积的微小变化忽略不计).试通过计算填写以下不同情况时两种溶液的体积比.
①若所得混合液为中性,则a:b=10:1;
②若所得混合液的pH=2,则a:b=9:2.
分析 (1)由图象可知,x=0时,y=13,y=0时,x=13,则有x+y=13,则KW=c(H+)×c(OH-)=(10-xmol•L-1)×(10-y mol•L-1)=10-13 mol2•L-2;
(2)若将此温度(t℃)下,pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合,此时NaOH溶液中c(OH-)=0.01mol/L,稀硫酸溶液中c(H+)=0.1mol/L,
①溶液呈中性,说明酸和碱恰好完全反应;
②若所得混合液的pH=2,根据c(H+)=$\frac{c酸V酸-c碱V碱}{V酸+V碱}$计算酸碱的体积比.
解答 解:(1)由图象可知,x=0时,y=13,y=0时,x=13,则有x+y=13,则KW=c(H+)×c(OH-)=(10-xmol•L-1)×(10-y mol•L-1)=10-13 mol2•L-2>10-14 mol2•L-2,水的电离是吸热的,Kw随温湿度升高而增大,所以该温度t>25℃,pH=6.5的溶液显中性,当pH=7的溶液显碱性,故答案为:10-13 mol2•L-2;>;碱;
(2)若将此温度(t℃)下,pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合,Kw=10-13 mol2•L-2;此时NaOH溶液中c(OH-)=0.01mol/L,稀硫酸溶液中c(H+)=0.1mol/L,则:
①若所得混合液为中性,则有0.01a=0.1b,a:b=10:1,
故答案为:10:1;
②若所得混合液的pH=2,则有$\frac{0.1b-0.01a}{a+b}$=0.01,解得:a:b=9:2,
故答案为:9:2.
点评 本题考查酸碱混合的定性判断,题目难度中等,注意水的离子积常数的计算,把握相关计算公式的运用.

练习册系列答案
相关题目
20.下列说法不正确的是( )
| A. | 形成酸雨的主要物质是硫的氧化物和氮的氧化物 | |
| B. | 海洋元素--溴的提取常用“空气吹出法”,该制备方法中溴元素依次经过被氧化、被还原、被氧化的三过程 | |
| C. | 绿色化学的核心就是如何对被污染的环境进行无毒无害的治理 | |
| D. | 水华、赤潮等水体污染主要是由含氮、磷的生活污水任意排放造成的 |
18.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z为地壳中含量最高的金属元素.下列说法正确的是( )
| X | ||||||
| Y | Z | W |
| A. | 工业上电解ZW3饱和溶液冶炼金属Z | |
| B. | 元素X的最高正价与W的最高正价相同 | |
| C. | 简单离子半径的大小顺序:r(X-)<r(Y+) | |
| D. | Y、W的最高价氧化物的水化物均能溶解金属Z |
5.瓦斯中氧气与甲烷的质量比为4﹕1时极易爆炸,此时氧气与甲烷的体积比为( )
| A. | 2﹕1 | B. | 1﹕2 | C. | 1﹕1 | D. | 1﹕4 |
19.阿伏加德罗常数为 NA,下列说法正确的是( )
| A. | 1 mol 钠与氧气反应生成 Na2O 或 Na2O2时,失电子数目均为 NA | |
| B. | 1 mol/L 的 NaOH 溶液中含 Na+数目为 NA | |
| C. | 标准状况下,2.24LC6H6 所含的分子数目为 0.1NA | |
| D. | 1 mol Na2O2 中含有的阴离子数目为 2NA |
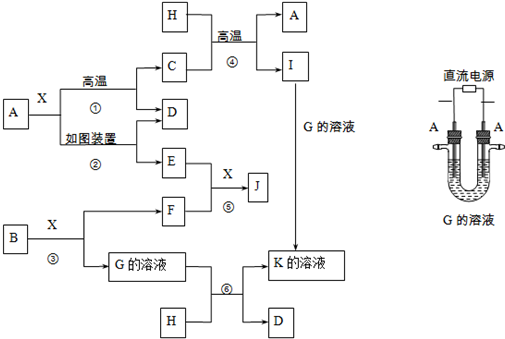
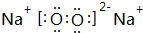
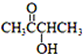 )有如下转化关系,且 1mol B反应生成了2mol C.
)有如下转化关系,且 1mol B反应生成了2mol C.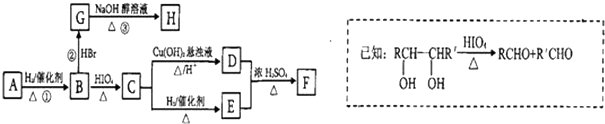
 .
.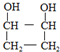 .
.
 .
.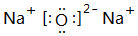 、
、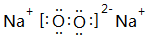 .
.