题目内容
15.实验室里用二氧化锰与浓盐酸反应来制取适量的氯气,反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O.现用100mL的浓盐酸与二氧化锰反应,生成的氯气在标准状况时的体积为5.6L,计算:(1)写出实验室制备氯气的离子反应方程式,并用双线桥标出电子的转移.
(2)被氧化的HCl的物质的量多少?
(3)电子转移物质的量是多少?
分析 (1)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,离子反应方程式只有HCl(浓)、MnCl2能拆,其余都不能拆;反应中锰元素化合价从+4价降为+2价,氯化氢氯元素从-1价升高为氯气中的0价,转移电子数为2e-;
(2)被氧化的HCl生成氯气,根据Cl原子守恒可知n被氧化(HCl)=2n(Cl2)计算;
(3)根据1Cl2生成转移2e-计算.
解答 解:(1)实验室制备氯气的离子反应方程式只有HCl(浓)、MnCl2能拆,其余都不能拆,则该离子方程式为MnO2+4H++Cl-$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++Cl2↑+2H2O;该反应中Mn元素化合价由+4价变为+2价,Cl元素化合价由-1价变为0价,转移电子数为2e-,用双线桥表示电子转移方向和数目为 ,故答案为:
,故答案为: ;
;
(2)5.6L氯气的物质的量=$\frac{5.6L}{22.4L/mol}$=0.25mol,
被氧化的HCl生成氯气,根据Cl原子守恒可知n被氧化(HCl)=2n(Cl2)=0.25mol×2=0.5mol,
答:被氧化的HCl的物质的量为0.5mol;
(3)根据 知,1Cl2生成转移2e-,则电子转移物质的量是=0.25mol×2=0.5mol,
知,1Cl2生成转移2e-,则电子转移物质的量是=0.25mol×2=0.5mol,
答:电子转移物质的量是0.5mol.
点评 本题考查氧化还原反应有关计算,为高频考点,熟悉方程式中各个物理量之间关系是解本题关键,注意该反应中浓盐酸的作用,题目难度不大.

练习册系列答案
相关题目
5.对人类生存环境不会造成危害的是( )
| A. | 生活污水的任意排放 | B. | 所有绿色植物的光合作用 | ||
| C. | 废电池的随意丢弃 | D. | 化肥和杀虫剂的大量使用 |
6.下列说法中正确的是( )
| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 熵值增大的反应都能自发进行 | |
| C. | 由能量判据和熵判据组合而成的复合判据,适合于所有的反应 | |
| D. | 同一物质的固、液、气三种状态的熵值相同 |
3.Fe、Fe2+、Fe3+三种微粒具有相同的:①质子数 ②中子数 ③核外电子数 ④化学性质( )
| A. | ①② | B. | ②④ | C. | ①③ | D. | ①④ |
20.为了探究原电池的电极名称不仅与电极材料有关还与电解质溶液有关,某学生做了如下的实验
根据以上表格内容回答:
(1)实验①中Mg作负极(填“正极”或“负极”),发生氧化反应(填“氧化反应”或“还原反应”).实验③中Mg作正极(填“正极”或“负极”),总反应的离子方程式为:2Al+2OH-+2H2O=AlO2-+3H2↑.
(2)实验②中Al电极上的电极反应式为2H++2e-═H2↑;.
(3)实验④中正极的电极反应式为NO3-+3e-+4H+=NO↑+2H2O.这样构成的原电池与常见的原电池不同,原因是铝在浓硝酸中发生了钝化.
| 编号 | 电极材料 | 电解质溶液 | 电子流向 |
| ① | Mg-Al | HNO3(浓) | Mg→Al |
| ② | Mg-Al | HCl(aq) | Mg→Al |
| ③ | Mg-Al | NaOH(aq) | Al→Mg |
| ④ | Al-Cu | HNO3(浓) | Cu→Al |
(1)实验①中Mg作负极(填“正极”或“负极”),发生氧化反应(填“氧化反应”或“还原反应”).实验③中Mg作正极(填“正极”或“负极”),总反应的离子方程式为:2Al+2OH-+2H2O=AlO2-+3H2↑.
(2)实验②中Al电极上的电极反应式为2H++2e-═H2↑;.
(3)实验④中正极的电极反应式为NO3-+3e-+4H+=NO↑+2H2O.这样构成的原电池与常见的原电池不同,原因是铝在浓硝酸中发生了钝化.
4.常温下,pH=2的二元弱酸H2R溶液与pH=12的NaOH溶液混合后,混合液的pH=7,下列判断正确的是.
| A. | 两溶液一定是等体积混合 | B. | 溶液中:c(R2-)+c(HR-)+c(OH-)=c(Na+)+c(H+) | ||
| C. | 溶液中2c(R2-)+c(HR-)=c(Na+) | D. | 溶液中:c(HR-)>c(Na+)>c(H+)=c(OH-) |
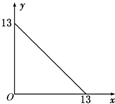 某温度(t℃)下的溶液中,[H+]=10-xmol•L-1,[OH-]=10-y mol•L-1,x与y的关系如图所示,请回答下列问题:
某温度(t℃)下的溶液中,[H+]=10-xmol•L-1,[OH-]=10-y mol•L-1,x与y的关系如图所示,请回答下列问题:
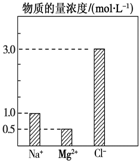 在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题: